Lexikon der Chemie: Nitrobenzoesäuren
Nitrobenzoesäuren, die drei strukturisomeren Mononitroderivate der Benzoesäure. Die N. sind farblose bis gelbliche, kristalline, wasserdampfflüchtige Verbindungen. Sie sind im Vakuum sublimierbar. Die N. sind in Wasser und Benzol schwer, in Methanol und Ether leichter löslich. In Alkalilaugen lösen sie sich unter Salzbildung. N. sind stärkere Säuren als die Benzoesäure. Man erhält die N. im Gemisch bei der direkten Nitrierung von Benzoesäure in Anteilen von etwa 80 % 3-, 18 % 2- und 2 % 4-N. Die gezielte Herstellung einzelner N. erfolgt nach speziellen Verfahren. 2-Nitrobenzoesäure bildet gelbliche, trikline Nadeln; F. 148 °C. Sie entsteht bei der Oxidation von 2-Nitrotoluol mit Kaliumpermanganat oder Salpetersäure. Sie wirkt toxisch auf niedere Organismen und wird daher zur Herstellung von Schädlingsbekämpfungsmitteln verwendet. Bei der Reduktion von 2-N. entsteht Anthranilsäure. 3-Nitrobenzoesäure bildet farblose, monokline Prismen; F. 142 °C. Man gewinnt sie durch direkte Nitrierung von Benzoesäure oder durch Nitrieren von Benzaldehyd und Oxidation des primär gebildeten 3-Nitrobenzaldehyds. Sie wird zur Herstellung von Azofarbstoffen verwendet. 4-Nitrobenzoesäure bildet farblose, monokline Prismen; F. 242 °C. Die Herstellung erfolgt durch Oxidation von 4-Nitrotoluol mit Kaliumpermanganat oder Salpetersäure. Sie wird hauptsächlich zur Gewinnung von 4-Aminobenzoesäure verwendet. Außerdem dient sie als Zwischenprodukt bei der Herstellung von Schädlingsbekämpfungsmitteln und pharmazeutischen Präparaten.
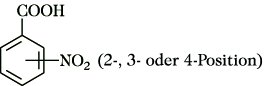
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.