Lexikon der Chemie: Phasenumwandlungswärme
Phasenumwandlungswärme, ältere Bezeichnung latente Wärme, Energie, die beim Übergang eines Stoffes aus einer Phase in eine andere freigesetzt oder verbraucht wird. P. werden in der Chemie auf die Stoffmenge 1 mol bezogen (molare P.). Werden Phasenumwandlungen bei konstantem Druck beobachtet, ist die P. eine Enthalpieänderung (molare Phasenumwandlungsenthalpie ΔPH). Sie ist gleich der Differenz der molaren Enthalpien H des reinen Stoffes in der entstehenden (′′) und der verschwindenden (') Phase: ΔPH = H′′ – H'. Erfolgt die Phasenumwandlung bei konstantem Volumen (was bei kondensierten Stoffen praktisch kaum realisierbar ist), so ist die P. eine Änderung der inneren Energie ΔPU (molare Phasenumwandlungsenergie). Eine Umkehr der Richtung des Phasenüberganges ändert nur das Vorzeichen der P. (Tab.). Aus dem 1. Hauptsatz der Thermodynamik folgt (∂H/∂n)p,T= ΔPH bzw. (∂H/∂n)V,T = ΔPU. Die P. sind temperaturabhängig. Die Temperaturabhängigkeit ergibt sich aus dem Kirchhoffschen Gesetz.
Phasenumwandlungswärme. Tab.: Art und Bezeichnung von Phasenumwandlungswärmen.
| ||
| fest flüssig | Schmelzwärme | Kristallisations- wärme |
| flüssig gasförmig | Verdampfungs- wärme | Kondensations- wärme |
| fest gasförmig | Sublimations- wärme | |
| fest fest | Modifikations- Umwandlungswärme |
Wird einem reinen Stoff bei konstantem Druck Wärme zugeführt, so bleibt seine Temperatur während eines Phasenübergangs so lange konstant, bis der gesamte Stoff in die neue Phase umgewandelt ist. Die zugeführte P. fährt zu einer Änderung der inneren Energie und der Enthalpie (Abb.). Ursachen sind sprunghafte Änderungen der Wechselwirkungsenergien zwischen den Teilchen und der Ordnungszustände in den beiden Phasen. Der Quotient ΔPH/Tu = ΔPS ist die molare Phasenumwandlungsentropie, ein Maß für die stattfindenden Ordnungsänderungen. In Mischphasen erfolgen Phasenumwandlungen im allg. nicht isotherm (Phasendiagramm).
Die P. können kalorimetrisch gemessen werden. Verdampfungs- und Sublimationswärmen sind besser aus der Temperaturabhängigkeit des Dampfdruckes mit Hilfe der Clausius-Clapeyronschen Gleichung zugänglich. Zur groben Abschätzung dienen die folgenden Regeln: Pictet-Troutonsche Regel: Die molare Verdampfungsentropie ΔVS, d. h. der Quotient aus molarer Verdampfungsenthalpie ΔVH und Siedetemperatur TS, ist bei Normaldruck (p = 0,1 MPa) für alle Flüssigkeiten annähernd gleich: ΔVS = ΔVH/TS ≈ 84 bis 92 J K-1 mol-1. Abweichungen treten bei sehr tief siedenden Stoffen (TS< 170 K), bei Metallschmelzen und bei assoziierenden Stoffen auf.
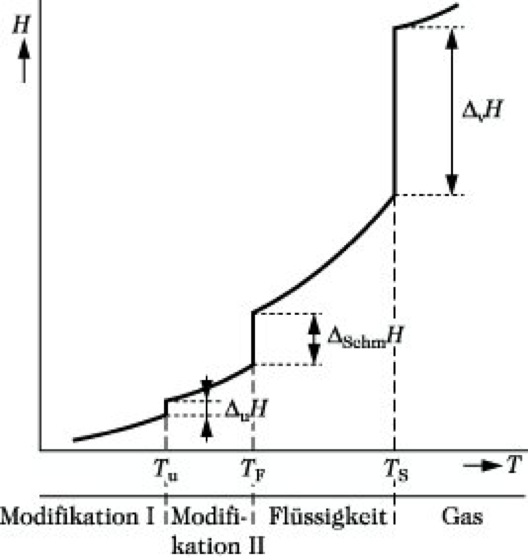
Phasenumwandlungswärme. Abb.: Abhängigkeit der molaren Enthalpie H reiner Stoffe von der Temperatur T (schematisch). Tu Temperatur des Modifikationswechsels I ![]()
II, TF Schmelztemperatur, TS Siedetemperatur, ΔuH, ΔSchmH, ΔVH molare Phasenumwandlungsenergien für Modifikationswechsel, Schmelzen bzw. Verdampfen.
Richardssche Regel: Die molare Schmelzentropie ΔSchmS = ΔSchmH/TF einatomiger Elemente liegt zwischen 7 und 14 J K-1 mol-1. Es bedeuten ΔSchmH molare Schmelzenthalpie, TF Schmelztemperatur.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.