Lexikon der Chemie: Redoxreaktion
Redoxreaktion, Reaktion, deren typisches Merkmal der Austausch von Elektronen ist; die Kombination einer stets gleichzeitig ablaufenden Oxidation und Reduktion. Wird ein Stoff oxidiert, d. h., er gibt Elektronen ab, ist er ein Reduktionsmittel, so geht er in eine Form über, die potentiell in der Lage ist, Elektronen aufzunehmen, somit als Oxidationsmittel zu fungieren. Die beiden an diesem Prozeß beteiligten, durch einfache Elektronenübertragung ineinander überführbaren Komponenten werden als korrespondierendes Redoxpaar (in Analogie zu Protonenübertragungsreaktionen) bezeichnet:
Red ![]()
Ox + e-
Fe2+ ![]()
Fe3+ + e-
Zn ![]()
Zn2+ + 2 e-
2 Cl- ![]()
Cl2 + 2 e-
H2 ![]()
2 H+ + 2 e-
Da in wäßriger Lösung Elektronen nicht frei existieren, ist die Abgabe von Elektronen durch ein Redoxpaar stets mit der Aufnahme dieser Elektronen durch ein zweites Redoxpaar gekoppelt:
Red1 + Ox2 ![]()
Ox1 + Red2
Zn + Cu2+ ![]()
Zn2+ + Cu
2 I- + Cl2 ![]()
I2 + 2 Cl-
AsO33- + I2 + H2O ![]()
AsO34- + 2 I-
5 H2O2 + 2 MnO-4 + 6 H+ ![]()
5 O2 + 2 Mn2+
+ 8 H2O
Bei der Formulierung von R. ist zu beachten, daß die Anzahl der von den einzelnen korrespondierenden Redoxpaaren abgegebenen und aufgenommenen Elektronen übereinstimmt. Bei komplizierten Redoxgleichungen werden die beiden beteiligten Teilprozesse in zwei getrennten Halbgleichungen formuliert. Auf der Basis der Oxidationszahlen der einzelnen Komponenten wird die Anzahl der übergeführten Elektronen für jede Teilreaktion bestimmt. O2--lonen werden zur Bilanzierung der Teilgleichungen mit H+-Ionen zu Wasser gebunden oder aus Wasser zur Verfügung gestellt. Ähnlich werden H+-lonen mit OH--Ionen zu Wasser gebunden oder ebenfalls vom Wasser geliefert. Nach geeigneter Multiplikation zur Erreichung der gleichen Anzahl sowohl abgegebener als auch aufgenommener Elektronen werden die Teilsysteme addiert. Dies ergibt beispielsweise für die Reaktion des Oxalats mit Permanganat in saurer Lösung zu Kohlendioxid und Mangan(II)-Ionen:
C2O24- ![]()
2 CO2 + 2 e- |× 5
MnO-4 + 8 H+ + 5 e- ![]()
Mn2+ + 4 H2O |× 2
5 C2O24-+ 2 MnO-4 + 16 H+ ![]()
10 CO2 + 2 Mn2+
+ 8 H2O
Die Lage des Redoxgleichgewichtes, somit die Frage, welches Redoxpaar ein anderes zu oxidieren oder zu reduzieren vermag, wird durch die Elektrodenpotentiale E der einzelnen Redoxsysteme bestimmt. Letztere sind entsprechend der Nernstschen Gleichung abhängig von den Standardelektrodenpotentialen E0 der Systeme und den Konzentrationsverhältnissen in der Lösung (z ist die Anzahl der übertragenen Elektronen):

Redoxpaare mit höheren, positiveren Eiektrodenpotentialen wirken gegenüber solchen mit niedrigeren Elektrodenpotentialen als Oxidationsmittel (Spannungsreihe). Im System Zn/ZnSO4-Cu/CuSO4 wird deshalb – vergleichbare Konzentrationen vorausgesetzt – das Redoxpaar Zn/Zn2+, E0 = -0,76 V, durch das Redoxpaar Cu/Cu2+, E0 = +0,34 V, oxidiert. Dies führt zu einer Erniedrigung der Konzentration an Cu2+-Ionen und zu einem Anstieg der Zn2+-Konzentration und somit zu einer Annäherung der Elektrodenpotentiale. Der Gleichgewichtszustand ist erreicht, wenn beide Potentiale gleich sind: ECu/Cu2+ = EZn/Zn2+. Damit kommt die Reaktion scheinbar zum Stillstand. Die Konzentrationsabhängigkeit der Elektrodenpotentiale macht auch die Relativität der Begriffe Oxidations- und Reduktionsmittel deutlich. Unter geeigneten Bedingungen lassen sich die Rollen von Oxidations- und Reduktionsmittel durchaus vertauschen.
Bei der Bestimmung der Elektrodenpotentiale für solche Reaktionen, die mit protolytischen Prozessen gekoppelt sind – das ist z. B. meist dann der Fall, wenn Derivate von Oxosäuren am Redoxvorgang beteiligt sind –, ist zu beachten, daß im Quotienten cox/cred der Nernstschen Gleichung nicht nur die an der unmittelbaren Elektronenübertragung beteiligten Komponenten zu berücksichtigen sind, sondern der gesamte Massenwirkungsausdruck zu erfassen ist. So gilt z. B. für das Redoxsystem MnO42- + 8 H+ + 5e-![]()
Mn2+ + 4 H2O die Gleichung
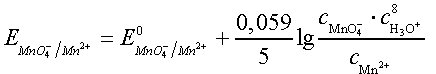
.
Daraus geht hervor, daß das Elektrodenpotential und somit die oxidierende Wirkung des Systems MnO4-/Mn2+ in hohem Maße pH-abhängig ist. Dies gilt für viele ähnlich gelagerte Fälle, und eine pH-Veränderung kann unter Umständen zu einer völligen Umkehr der Reaktionsrichtung führen. Beispielsweise liegt im sauren Bereich das Gleichgewicht der Reaktion
weitgehend auf der linken, im basischen auf der rechten Seite der Gleichung. Auf dieser Basis ist auch zu verstehen, daß unter stark sauren Bedingungen Chlorat mit Chlorid zu Chlor reagiert, während in basischem Milieu Chlor zu Chlorid und Chlorat disproportioniert.
Über spezielle R. Disproportionierung und Komproportionierung.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.