Lexikon der Chemie: Schwefel
Schwefel, Symbol S, chem. Element aus der VI. Hauptgruppe des Periodensystems, der Gruppe der Chalkogene (Sauerstoff-Schwefel-Gruppe), Nichtmetall; Z 16, Massenzahlen der natürlichen Isotope 32 (95,0 %), 33 (0,76 %), 34 (4,22 %), 36 (0,014 %), Atommasse 32,064, Wertigkeit II, IV, VI, Härte nach Mohs 2 (α-Schwefel), D. 2,07 g cm-3 (α-Schwefel), F. 119,0 °C, Kp.444,674 °C, Standardelektrodenpotential (S2-/S) -0,508 V.
Eigenschaften. S. vermag abhängig von der Temperatur in mehreren enantiotropen Modifikationen aufzutreten. Die bei Zimmertemperatur thermodynamisch stabile Form ist der gelbe, bei tiefer Temperatur fast farblose α-Schwefel Er besteht aus kronenförmigen S8-Molekülen, Cyclooctaschwefel (Abb. 1), die ein rhombisches Gitter aufbauen. Bei 95,4 °C geht α-S. unter Erhalt der S8-Molekülstruktur in den hellgelben, monoklinen β-Schwefel über, der bei 119,6 °C schmilzt.
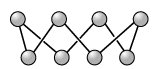
Schwefel. Abb. 1: Cyclooctaschwefel S8.
Im flüssigen S. befinden sich verschiedene Modifikationen in einem temperaturabhängigen Gleichgewicht. Unmittelbar oberhalb der Schmelztemperatur besteht die hellgelbe, leichtbewegliche Schmelze nach erfolgter Gleichgewichtseinstellung überwiegend aus S8-Molekülen, dem λ-Schwefel, neben etwa 5 % π-Schwefel. Letzterer ist ein Gemisch aus S6-, S7- und Sx-Ringen (x > 8), und seiner Bildung ist es zuzuschreiben, daß der Erstarrungspunkt dieser Schmelze etwa 5 °C unter dem Schmelzpunkt von reinem β-S. liegt. Mit steigender Temperatur brechen S8-Moleküle auf und treten zu kettenförmigen Makromolekülen zusammen, die man als μ-Schwefel bezeichnet. Mit der so verursachten Vergrößerung der Molekülmassen geht eine Erhöhung der Viskosität der Schmelze einher, die bei 187 °C ein Maximum erreicht und bei weiter steigender Temperatur wieder sinkt. Gleichzeitig verändert sich die Farbe nach dunkelrotbraun. Schreckt man die etwa 200 °C heiße Schmelze z. B. durch Eingießen in kaltes Wasser ab, so erhält man den aus S8-Molekülen und μ-S. bestehenden amorphen plastischen S. Dieser wandelt sich langsam wieder in die rhombische Form um. Der dunkelrote Schwefeldampf besteht unmittelbar oberhalb des Siedepunktes vor allem aus S8- neben S6-, S4- und S2-Molekülen. Mit steigender Temperatur nimmt der Anteil der S2-Moleküle zu; oberhalb 1800 °C beobachtet man Zerfall in Schwefelatome. Neben den beschriebenen Modifikationen wurden durch gezielte Synthese weitere Formen des S. gewonnen, die aus 6 bis 20 Schwefelatomen aufgebaute Ringe enthalten.
α-S. hat nur geringes Leitvermögen für Wärme und elektrischen Strom. Durch Reiben wird er stark negativ aufgeladen. Die Löslichkeit der S. in Kohlendisulfid ist abhängig von der Molekülstruktur. Während sich z. B. α- und β-S. (Cyclooctaschwefel) sehr gut lösen (100 g CS2 lösen bei 0 °C 24,0 g, bei 55 °C 181,3 g S.), ist μ-S. weitgehend unlöslich. In Wasser ist S. beinahe unlöslich; die Löslichkeit in Benzol, Ethanol, Ether und anderen organischen Lösungsmitteln ist gering.
S. ist sowohl hinsichtlich seiner Oxidationszahlen (-2, +4, +6) als auch seiner Koordinationszahlen (1 bis 6) sehr variabel. Bemerkenswert ist seine Neigung, lange unverzweigte Schwefelketten (z. B. in Polysulfanen und Polysulfandisulfonsäuren) zu bilden.
Bei Zimmertemperatur ist S. relativ reaktionsträge. Bei etwa 260 °C entzündet er sich an der Luft und verbrennt mit schwacher, blauer Flamme zu einem Gemisch aus Schwefeldioxid SO2 und geringen Anteilen Schwefeltrioxid SO3. Mit Wasserstoff vereinigt sich S. bei etwa 600 °C zu Schwefelwasserstoff H2S. Mit Fluor reagiert er in der Kälte unter Bildung von Schwefelhexafluorid SF6. Chlor setzt sich mit geschmolzenem S. zu Dischwefeldichlorid S2Cl2 um. Mit den meisten Metallen bildet S. in oft stark exothermer Reaktion entsprechende Sulfide, z. B. 2 Al + 3 S → Al2S3. Mit siedender wäßriger Ammoniak- oder Alkalimetallhydroxidlösung reagiert S. zu Polysulfiden und Thiosulfaten.
S. ist für den menschlichen Organismus ungiftig. Die Haut reagiert nach längerer Einwirkung von S. mit leichter Reizung.
Analytisches. Elementaren S. erkennt man an seiner gelben Farbe und daran, daß er zu SO2 verbrennt, das als Sulfit nachzuweisen ist.
Vorkommen.S. ist am Aufbau der Erdkruste zu 0,048 % beteiligt. Man findet ihn in der Natur als Element sowie in Form von Sulfiden und Sulfaten. Wichtige Minerale sind z. B. Pyrit (Eisenkies) FeS2, Chalkopyrit (Kupferkies) CuFeS2 Galenit (Bleiglanz) PbS, Sphalerit (Zinkblende) ZnS, Anhydrit CaSO4, Gips CaSO4·2 H2O, Kieserit MgSO4·H2O, Baryt (Schwerspat) BaSO4, Mirabilit (Glaubersalz) NaSO4·10 H2O. Steinkohle und Braunkohle enthalten meist 1 bis 1,5 % S.; auch in Erdöl, Ölschiefer u. ä. sind unterschiedliche, von der Herkunft abhängige Mengen S. enthalten. In vulkanischen Gasen und Erdgasquellen kommt S. als Schwefelwasserstoff oder Schwefeldioxid vor, in Schwefelquellen in Form von Schwefelwasserstoff oder Hydrogensulfiden. In der belebten Natur ist S. unter anderem Bestandteil einiger proteinogener Aminosäuren (Cystin, Cystein, Methionin); einige Pflanzen produzieren Senföle (Isothiocyanate).
Gewinnung. Ausgangsbasis zur industriellen Schwefelgewinnung sind sowohl die Lagerstätten des elementaren S. als auch der in Erd- und Synthesegasen enthaltene Schwefelwasserstoff.
Von herausragender Bedeutung ist heute das Frasch-Verfahren, das die Gewinnung von elementarem S. aus Schwefelerzen ohne vorherigen bergmännischen Abbau ermöglicht, dessen Anwendung allerdings an bestimmte geologische Gegebenheiten geknüpft ist. Beim Frasch-Verfahren führt man in ein bis zum Boden der Lagerstätte vorgetriebenes Bohrloch drei koaxiale Rohre ein. (Abb. 2). Durch das äußere, Rohr wird überhitzter Wasserdampf von etwa 170 °C durch Öffnungen im oberen Teil des Rohrfußes in das Schwefellager gepreßt, so daß der S. zum Schmelzen gebracht wird. Der flüssige S. sammelt sich an der tiefsten Stelle, tritt durch Öffnungen im unteren Teil des Rohrfußes in diesen ein und wird von hier durch heiße Druckluft, die durch das innere Rohr in den Rohrfuß strömt, zusammen mit dem Wasser durch das mittlere Rohr nach oben gerissen. Da dieses Steigrohr von überhitztem Wasserdampf umgeben ist, bleibt der S. auch während der Förderung flüssig. In großen Behältern läßt man den S. zu Blöcken erstarren. Der so gewonnene S. ist im allgemeinen über 99,5%ig.

Schwefel. Abb. 2: Fußkörper der Schwefelpumpe nach Frasch.
Zur Abtrennung des Schwefelwasserstoffs aus Synthese- und Erdgasen, die nicht nur wirtschaftliche Bedeutung hat, sondern auch aus Gründen des Umweltschutzes erforderlich ist, wird H2S meist zunächst durch Adsorptionsverfahren oder durch Waschungen angereichert und üblicherweise nach dem in vielen Varianten betriebenen Claus-Verfahren (Abb. 3) in Schwefel umgewandelt.

Schwefel. Abb. 3: Schema einer Claus-Anlage.
Hierbei wird zunächst ein Drittel des H2S abgezweigt und bei gleichzeitiger Nutzung der frei werdenden Energie zu Schwefeldioxid verbrannt: 2 H2S + 3 O2 → 2 SO2 + 2 H2O; ΔH = -1038 kJ/mol. Das SO2 wird dann mit den verbliebenen zwei Dritteln des H2S vereinigt und in Gegenwart eines Bauxit-Katalysators umgesetzt:
2 SO2 + 4 H2S → 6 S + 4 H2O; ΔH = -293 kJ/mol. Zur Abtrennung des H2S aus Synthese- oder Erdgas wird auch Eisenoxidhydrat eingesetzt, das in Eisensulfid übergeführt wird: Fe2O3 + 3 H2S → Fe2S3 + 3 H2O. Wenn die Gasreinigungsmasse erschöpft ist, wird mit Luftsauerstoff gemäß Fe2S3 + 3/2 O2 → Fe2O3 + 3/8 S8 regeneriert, und der S. wird mit Kohlendisulfid oder Ammoniumsulfidlösung extrahiert. Sublimierter S. wird als feinpulvrige Schwefelblume oder Schwefelblüte angeboten.
Verwendung. Mehr als 90 % des produzierten S. werden zu Schwefeldioxid verbrannt und zu Schwefelsäure verarbeitet. Beträchtliche Mengen dienen zur Vulkanisation von Kautschuk. Auch zur Herstellung von Sprengstoffen und in der Zündholzfabrikation wird S. eingesetzt. S. ist Synthesegrundstoff zur Herstellung von Kohlendisulfid, Farbstoffen, Pharmazeutika und Pflanzenschutzmitteln. Durch Verbrennen von S. gebildetes Schwefeldioxid wirkt desinfizierend beim Ausschwefeln von Fässern, Konservengläsern u. ä. Bedeutung hat S. auch als Baustoff bzw. Verbindungsmaterial in Form des Schwefelbetons erlangt.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.