Lexikon der Chemie: Stickstoffoxide
Stickstoffoxide. Tetrastickstoffmonoxid, auch Nitrosylazid, N4O, F. -59 °C (Z.), ΔH0B + 467 kJ/mol. Tetrastickstoffmonoxid ist nur unterhalb seines Schmelzpunktes stabil und zerfällt bei höherer Temperatur exotherm zu N2O und N2. Die Synthese erfolgt gemäß: NaN3 + NOCl → N4O + NaCl.
Distickstoffoxid, N2O, farbloses Gas, F. -90,8 °C, Kp. -88,5 °C, krit. Temp. 36,5 °C, krit. Druck 7,17 MPa. N2O ist mit CO2 und dem Azid-Ion N-3 isoster und hat linearen Bau:
In der Kälte ist N2O relativ reaktionsträge, in der Hitze zerfällt es in Stickstoff und Sauerstoff. Es unterhält deshalb die Verbrennung. Man gewinnt NO2 durch Erhitzen von Ammoniumnitrat: NH4NO3 → N2O + 2 H2O. Eingeatmet wirkt es berauschend und ruft Lachlust hervor (Lachgas). Es wird in der Medizin als Narkotikum verwendet.
Stickstoffmonoxid, Stickstoffoxid, Stickoxid, NO, farbloses, in Wasser wenig lösliches Gas; F. -163,6 °C, Kp. -151,8 °C, krit. Temp. -93°C: krit. Druck 6,4 MPa. Das NO-Molekül hat ein ungepaartes Elektron, und dimerisiert über eine schwache π*-π*-Bindung zu cis-N2O2. Der Bindungszustand läßt sich am einfachsten anhand des MO-Schemas für zweiatomige Moleküle beschreiben, woraus hervorgeht, daß das ungepaarte Elektron ein antibindendes Molekülorbital besetzt und eine Bindungsordnung von 2,5 resultiert. Konsequenterweise läßt sich dieses Elektron leicht unter Bildung stabiler Nitrosyl-Kationen NO+ abtrennen (z. B. NO+HSO4-). Durch Sauerstoff wird NO sofort in braunes Stickstoffoxid übergeführt gemäß 2 NO + O2 → 2 NO2, mit den Halogenen (außer Iod) reagiert es zu Nitrosylhalogeniden NOX (X = F, Cl, Br, z. B. Nitrosylchlorid). Im Laboratorium stellt man NO durch Reduktion von verd. Salpetersäure mit Kupfer her: 8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 2 NO + 4 H2O. Industriell gewinnt man das Gas durch katalytische Ammoniakverbrennung (Ostwald-Verfahren, Salpetersäure).
NO wird im Menschen aus der Aminosäure Arginin gebildet und wirkt als Hormon. NO-Generatoren wie Salpetersäureester (Glycerintrinitrat) werden therapeutisch bei Angina pectoris eingesetzt.
|
Distickstofftrioxid, N2O3, nur in festem Zustand existierende, blaue Verbindung; F. -102 °C. Mit steigender Temperatur verschiebt sich das Dissoziationsgleichgewicht N2O3![]()
NO + NO2 nach rechts. Entsprechend der Beziehung
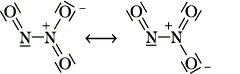
bildet sich N2O3 bei Zusammenfügen äquimolarer Mengen NO und NO2. N2O3 ist das formale Anhydrid der salpetrigen Säure. Mischungen gleicher Teile NO und NO2 reagieren mit Alkalihydroxidlösungen zu entsprechenden Nitriten.
Stickstoffdioxid, NO2 leicht zu verflüssigendes Gas; D. 1,4494 g cm-3, F. -11,20 °C, Kp. 21,2 °C, krit. Temp. 157,8 °C, krit. Druck 10 MPa. Das paramagnetische rotbraune NO2 steht mit dem diamagnetischen farblosen Distickstofftetroxid N2O4 gemäß 2 NO2![]()
N2O4, ΔH = -57 kJ/mol im Gleichgewicht, dessen Lage sich mit sinkender Temperatur nach rechts verschiebt:
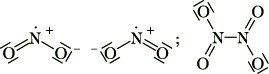
Oberhalb 200 °C zerfällt NO, in NO und O2. Es wirkt stark oxidierend. NO2 bzw. N2O4 verhalten sich wie das gemischte Anhydrid der salpetrigen Säure und der Salpetersäure. Entsprechend bilden sie mit Alkalihydroxidlösungen Nitrite und Nitrate, z. B. 2 NO2 + 2 NaOH → NaNO2 + NaNO3 + H2O. Im Labor stellt man NO2 durch Erhitzen von Schwermetallnitraten her, z. B. Pb(N03)2 → 2 NO2 + PbO + 1/2 O2. Technisch gewinnt man es als Zwischenprodukt der Salpetersäuresynthese durch Luftoxidation von NO.
Distickstoffpentoxid, N2O5, farblose, rhombische oder hexagonale Kristalle, F. 30°C, Z. 47 °C. N2O5 ist das Anhydrid der Salpetersäure: N2O5 + H2O → 2 HNO3. Es bildet sich in Umkehrung vorstehender Gleichung bei der Entwässerung von HNO3 mit Phosphor(V)-oxid. Festes N2O5, liegt als ionisches Nitrylnitrat NO2+NO-3 vor und geht bei Temperaturerhöhung in die molekulare Form O2N-O-NO2 über. Es neigt zur Explosion.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.