Lexikon der Chemie: Thioalkohole
Thioalkohole, ältere Bezeichnung Mercaptane, organische Schwefelverbindungen der allg. Formel R-SH, bei denen die Thiolgruppe mit einem Alkylrest R verknüpft ist. T. sind S-Analoge der Alkohole. Bei der systematischen Benennung der T. wird der Name des Stammkohlenwasserstoffs mit dem Suffix -thiol verbunden, z. B. Ethanthiol (Ethylmercaptan) C2H5-SH, Phenylmethanthiol (Benzylmercaptan) C6H5-CH2-SH. Mit Ausnahme des gasförmigen Methanthiols sind die T. flüssige oder auch feste Verbindungen. Ihre Siedepunkte liegen niedriger als die der entsprechenden Alkohole, da sie wenig Neigung zur Ausbildung von Wasserstoffbrückenbindungen zeigen. Sie sind auch weniger in Wasser löslich als Alkohole. T. wirken toxisch und haben einen widerwärtigen Geruch. Die Geruchsschwelle für Ethanthiol liegt bei 4,6·10-8 mg, d. h., es werden noch geringste Spuren wahrgenommen.
(E)-But-2-en-1-thiol ist der Hauptbestandteil des übelriechenden Sekrets des nordamerikanischen Stinktiers.
T. sind stärkere Säuren als Alkohole. Sie bilden deshalb im Gegensatz zu Alkoholen in wäßriger Lösung mit Alkalihydroxiden Salze, die als Thiolate bezeichnet werden: R-SH + NaOH → R-S-Na+ + H2O.
Auch mit Schwermetall-Ionen entstehen solche Salze, die schwer löslich sind und kovalente Verbindungen darstellen. Auf der Bildung von Blei(II)- und Quecksilber(II)-thiolaten beruht eine Nachweisreaktion von T. Zum anderen ist die toxische Wirkung dieser Schwermetall-Ionen im Körper auf die feste Bindung an biologisch wirksame Substanzen mit Thiolgruppen (Cystein) und deren Blockierung zurückzuführen. Die Alkalithiolate sind starke nucleophile Reagenzien. Durch Umsetzung mit Halogenalkanen werden Thioether gebildet: R-S- + R'-Br → R-S-R' + Br-.
Deutliche Unterschiede gegenüber Alkoholen zeigen die T. auch im Verhalten gegenüber Oxidationsmitteln. Man erhält keine Thiocarbonylverbindungen, sondern mit milden Oxidationsmitteln, z. B. Wasserstoffperoxid oder Luft, Disulfide R-S-S-R, mit starken Oxidationsmitteln, z. B. Kaliumpermanganat oder Salpetersäure, Sulfonsäuren R-SO3H. Weitere Reaktionen der T. sind die Umsetzung mit Carbonsäuren zu Carbonsäurethiolestern R-COSR', die durch starke Säuren katalysiert wird, die Bildung von Mercaptalen und die Desulfurierung zu Kohlenwasserstoffen, die große technische Bedeutung zur Entfernung von T. aus Erdölfraktionen hat. Bei der Hydroraffination erfolgt diese Reaktion mit Wasserstoff in Gegenwart von Molybdän(IV)- oder Wolfram(IV)-sulfid bei 300 bis 400 °C und Drücken von 2·106 bis 4·106 Pa.
Analytisches. Zum Nachweis kann die Bildung der gelben Blei(II)- und farblosen Quecksilber(II)-thiolate herangezogen werden. In den IR-Spektren der T. sind typische Banden in den Bereichen von 2550 bis 2600 cm-1 (S-H-Valenzschwingungen) und 570 bis 705 cm-1 (C-S-Valenzschwingungen) zu beobachten.
Herstellung.1) aus Halogenalkanen und Alkalihydrogensulfiden: R-Br + NaSH → R-SH + NaBr. Als Nebenprodukte können Dialkylsulfide (Thioether) gebildet werden, indem der T. in der basischen Lösung mit überschüssigem Halogenalkan weiterreagiert. 2) aus Halogenalkanen und Thioharnstoff über S-Alkylisothiuroniumsalze und deren Hydrolyse mit Alkalilauge. Hierbei werden keine Thioether gebildet:
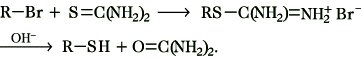
3) aus Alkoholen und Schwefelwasserstoff bei Temperaturen von 300 bis 400 °C an Aluminiumoxidkatalysatoren durch Austausch von Sauerstoff gegen Schwefel. 4) durch Addition von Schwefelwasserstoff an Alkene bei 150 bis 300 °C in Gegenwart von Aluminiumoxid- und Nickelsulfidkatalysatoren: R-CH=CH2 + H2S → R-CH(SH)-CH3.
Verwendung. T. werden zu organischen Synthesen, zur Herstellung von Schädlingsbekämpfungsmitteln und indigoiden Farbstoffen, in der Kautschukindustrie als Vulkanisationsbeschleuniger und Alterungsschutzmittel eingesetzt.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.