Lexikon der Chemie: Thiocarbonsäuren
Thiocarbonsäuren, Verbindungen, die sich von den Carbonsäuren durch Ersatz eines oder beider Sauerstoffatome der Carboxygruppe durch Schwefel ableiten. Bei den Monothiocarbonsäuren ist ein Sauerstoffatom durch ein Schwefelatom ersetzt. Sie sind tautomer, das Gleichgewicht liegt meist vollständig auf der Seite der Thiolsäure. Der Name der Säuren leitet sich von dem der Carbonsäure ab,
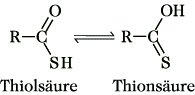
zwischen den Stammnamen des Restes R und -säure wird -thiol- bzw. -thion- einschoben, z. B. Ethanthiolsäure bzw. Ethanthionsäure. Außerdem werden Trivialnamen verwendet, z. B. Thioessigsäure. Monothiocarbonsäuren haben einen unangenehmen Geruch, sie sind meist gelb gefärbt. Es sind feuchtigkeitsempfindliche Flüssigkeiten, die auf Verbindungen mit aktiven Wasserstoffatomen acylierend wirken, z. B. werden mit Alkoholen Carbonsäureester gebildet. Monothiocarbonsäuren entstehen bei der Umsetzung von Carbonsäuren mit Phosphor(V)-sulfid oder bei der Einwirkung von Carbonsäurechloriden oder -anhydriden auf H2S. In der analytischen Chemie dienen sie zur Fällung von Schwermetallsulfiden. Von den T. leiten sich die Thioester ab, von den Thiolsäuren die Thiolcarbonsäureester R1-CO-SR2, von den Thionsäuren die Thioncarbonsäureester R1-CS-OR2. Thionthiolsäuren (Dithiocarbonsäuren) haben die Struktur R-CS-SH. Es sind sehr unbeständige, übelriechende, gelbrot gefärbte Flüssigkeiten, die an der Luft sehr schnell zu Thioacyldisulfiden R-CS-S-S-CS-R oxidiert werden. Die freien Säuren werden durch Addition von Grignard-Verbindungen an CS2 gewonnen, deren Alkylierung ergibt die Ester. Sie werden zur Thioacylierung verwendet.
Von den T. leiten sich Thioamide ab. T. sind im allgemeinen reaktiver als die entsprechenden Carbonsäuren.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.