Lexikon der Chemie: Vitamin C
Vitamin C, Ascorbinsäure, ein wasserlösliches Vitamin mit der Struktur eines in der prototropen Endiolform vorliegenden 3-Oxo-L-gulonsäure-γ-lactons.
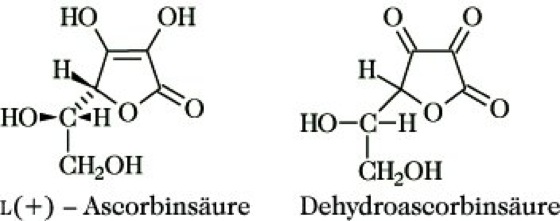
Es hat zwei chirale C-Atome. Biologische Aktivität weist lediglich die L(+)-Ascorbinsäure auf. Der relativ stark saure Charakter ist durch die OH-Gruppe am C3-Atom bedingt (pKS = 4,2). Die andere enolische OH-Gruppe hat keine sauren Eigenschaften (pKS = 11,6). V. C bildet neutral reagierende Monoalkalisalze. Als Endiol wirkt V. C stark reduzierend. Erstes Oxidationsprodukt ist die Dehydroascorbinsäure, mit der L(+)-Ascorbinsäure ein reversibles Redoxpaar bildet.
V. C ist in fester Form stabil, in Lösung dagegen, insbesondere in Gegenwart von Kupfer(II)- und Eisen(III)-Ionen, durch Luftsauerstoff leicht oxidierbar. Das Stabilitätsoptimum liegt bei pH 5,6.
V. C wird heute synthetisch ausgehend von D-Glucose gewonnen.
V. C ist in der Natur weit verbreitet. Besonders reichlich kommt es in Hagebutten, in Zitrusfrüchten und anderem Obst sowie in Frischgemüse vor. V. C ist nur für Mensch, Affe und Meerschweinchen ein Vitamin. Die meisten Tiere können es selbst synthetisieren. V. C hat keine Coenzymfunktion. Es ist aufgrund seiner Redoxreaktion an Hydroxylierungsreaktionen beteiligt. Der normale Tagesbedarf des Erwachsenen beträgt etwa 75 mg, kann aber wesentlich ansteigen. Fehlende Zufuhr von V. C führt zum Skorbut, der sich in Blutungen der Haut und der Schleimhäute und in schmerzhaften Schwellungen der Gelenke äußert. Bei normaler Ernährung tritt Skorbut nicht auf. Bei einseitiger Ernährung und falscher Nahrungszubereitung können dagegen Hypovitaminosen mit leichter Ermüdbarkeit, Anfälligkeit gegenüber Infektionskrankheiten und Zahnfleischblutungen auftreten. Die Infektionsprophylaxe mit hohen Dosen V. C ist umstritten. Therapeutisch wird V. C bei C-Hypovitaminosen verwendet.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.