Lexikon der Ernährung: ATP-Synth(et)ase-Komplex
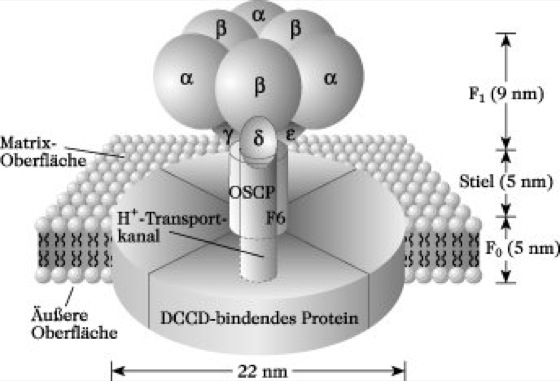
ATP-Synth(et)ase-Komplex, ATP-Synthase, F0F1-ATPase, F-ATPase, ein in der Mitochondrienmembran lokalisiertes Enzymsystem, das den größten Teil des ATP synthetisiert (oxidative Phosphorylierung). Die A. wurde 1960 von E. Racker und Mitarbeitern aus Mitochondrien isoliert und 1961 postulierte P. Mitchell einen Reaktionsmechanimus für dieses Enzym. Danach wird die ATP-Synthese durch den an der inneren Mitochondrienmembran über die Redoxreaktionen der Atmungskette aufgbauten Protonengradienten (chemiosmotische Theorie) angetrieben. Die A. ist ein multiples Untereinheiten-Enzym (Mr 450 kDa, Abb.) und macht etwa 15 % des Gesamtproteingehaltes der inneren Mitochondrienmembran aus (vgl. Atmungskette, Abb. 2). Sie besteht aus der F1-Komponente mit der Zusammensetzung α3β3γδℇ, der F0-Komponente, die vier bis fünf unterschiedliche Untereinheiten und sechs bis zehn Kopien eines DCC-(Dicyclohexylcarbodiimid-)Bindungsproteins enthält, einem Stiel, der aus zwei Proteinen, dem OSC-Protein (OSCP, Eoligomycin-sensitivity-confering protein), sowie dem Kupplungsfaktor 6 (F6) besteht (Abb.) und weiteren assoziierten Polypeptiden.
Das Katalysezentrum für die ATP-Synthese ist in der β-Untereinheit der F1-Komponente lokalisiert, während die δ-Untereinheit die Zugangsverbindung des F0-Protonenkanals mit F1 bildet. Das DCC-Bindungsproteolipid-Oligomer bildet den Protonenkanal und der Stiel ist zur Bindung von F0 an F1 erforderlich.
Paul Boyer, einer der Nobelpreisträger für Chemie und Medizin 1997, hatte herausgefunden, dass nicht die Synthese von ATP aus ADP den energieaufwendigsten Schritt darstellt, sondern dass vor allem die Bindung von ADP und anorganischem Phosphat an das Enzym und die Freisetzung des Produktes ATP aus dem Enzym Energie verbrauchen. Diese Erkenntnis steht im Widerspruch zu den meisten enzymatischen Reaktionen, bei denen die Bindung von Substraten und die Produktfreisetzung spontan verlaufen und nur der katalytische Schritt selbst Energie benötigt. Nach Boyer katalysiert die A. den Reaktionsweg nur in einer Richtung, die dadurch zustande kommt, dass die γ-, δ- und ℇ-Untereinheiten in einem Zylinder rotieren, der wiederum durch alternierende α- und β-Untereinheiten gebildet wird. Dieser Mechanismus wird vom Protonenfluss durch die Mitochondrienmembran angetrieben. Die Vorstellungen über die biochemischen Vorgänge konnten durch die Röntgenkristallstrukturanalyse der A. bestätigt werden, an der John E. Walker, ein zweiter Nobelpreisträger von 1997, entscheidenden Anteil hatte.
ATP-Synth(et)ase-Komplex: ATP-Synth(et)ase-Komplex
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.