Lexikon der Ernährung: Hämoglobin
Hämoglobin, Hb, Blutfarbstoff, ein sauerstofftransportierendes Protein, wlches bei Wirbeltieren für die rote Farbe des Bluts verantwortlich ist. Es liegt in den Erythrocyten (rote Blutkörperchen) als 34 %ige Lösung vor.
Struktur: Hb ist ein Tetramer, das aus zwei Polypeptidkettenpaaren und vier Hämgruppen (Häm) besteht (Abb.). Bei einem Fe2+-Gehalt von 0,334 % sind im Hb 3,3 g oder 75 % des Gesamtkörpereisens (Eisen) enthalten. Die tägliche Synthese liegt bei 57 g Hb, beim Abbau wird das Eisen zur Hb-Neusynthese verwandt, während das Porphyringerüst des Häms zu Billiverdin bzw. Bilirubin umgewandelt wird (Gallenfarbstoffe). Das Hb des erwachsenen Menschen besteht zu 96,5–98,5 % aus HbA1 (α2α2) und zu 1,5–3,5% aus HbA2 (α2δ2).
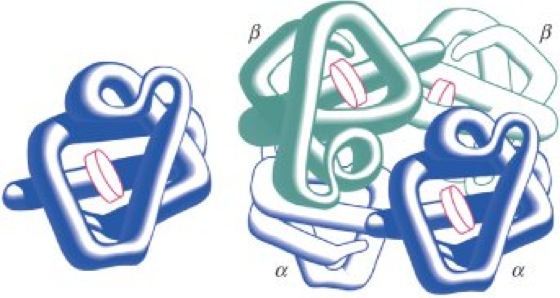
Die Hämoglobinketten sind ähnlich wie das Myoglobinmolekül gefaltet (Abb.). Auch die Fixierung der Hämgruppe über ihr Eisen(II)-Atom an zwei Histidinreste sowie über hydrophobe Wechselwirkungen in der Hämtasche entspricht der Anordnung im Myoglobin. Wesentlich komplizierter sind jedoch die nichtkovalenten Wechselwirkungen zwischen den einzelnen Hämoglobinketten. Sie bilden die Grundlage für die Wechselwirkungen der vier räumlich getrennten Hämgruppen bei der reversiblen kooperativen Bindung von vier Sauerstoffmolekülen je Hämoglobinmolekül (allosterischer Effekt).
Genetische Regulation: Das Globin wird von mindestens sieben verschiedenen Strukturgenen kodiert, die auf den Chromosomen 11 und 16 als Cluster vorliegen.
Jedes haploide Genom weist zwei α-Gene auf, d. h. insgesamt sind vier α-Gene vorhanden. In der embryonalen Entwicklung treten drei Hb-Formen sehr früh auf: x2e2 (Hb Gower), χ2γ2 (Hb Portland) und α2e2 (Hb Gower 2). Nach dem dritten Schwangerschaftsmonat werden die x- und e-Polypeptide nicht mehr synthetisiert, alle drei embryonalen Hämoglobine (Hb Es) verschwinden und werden durch das Fetalhämoglobin (Hb F, α2γ2) ersetzt.
Hb E und Hb F unterscheiden sich vom Adult-Hb durch ihre höhere O2-Affinität, die den Gasaustausch zwischen dem embryonalen und dem mütterlichen Blut ermöglicht (Gefälle des Sauerstoff-Partialdrucks von der Atemluft über das mütterliche Blut zu embryonalem / fetalem Blut). Alle Menschen und sogar die Schimpansen besitzen ein identisches Hämoglobin. Anomalien sind pathologisch (die häufigste und bekannteste Hämoglobinopathie ist das Sichelzellhämoglobin).Physiologische Funktionen: Hb transportiert Sauerstoff von der Lunge zu den Geweben. Unter zwei Voraussetzungen vermag Blut 70-mal mehr O2 an Hb zu binden, als durch reine physikalische Lösung im Blutvolumen möglich wären:
1) Hb darf nicht durch Kohlenmonoxid (CO) besetzt sein. CO wird von Hb mit etwa 300-facher Affinität im Vergleich zu O2 gebunden, es kommt also bereits bei geringen CO-Gehalten der Atemluft (Abgase) zur CO-Vergiftung (tödlich, wenn 60 % des Hb als HbCO [Carboxyhämoglobin] vorliegen).
2) Das zentrale Hämeisen muss als Fe2+ (reduziert) vorliegen. Oxidationsmittel (z. B. Nitrate) oxidieren es zu Fe3+, es entsteht Methämoglobin (MetHb, Hämiglobin), welches keinen Sauerstoff reversibel anlagern kann. In den Erythrocyten wird MetHb durch Methämoglobinreductase zu Hb reduziert.
Die Anlagerung von Sauerstoff ist eine Oxigenierung und keine Oxidation, d. h. das Hämeisen bleibt zweiwertig. Die Bindung eines O2-Moleküls an die erste Hb-Untereinheit erleichtert die Bindung weiterer O2-Moleküle an die weiteren Untereinheiten (allosterischer / kooperativer Effekt, s. o.), man beobachtet also eine sigmoide Sättigungskurve.
Die O2-Affinität wird durch hohen CO2-Partialdruck und niedrigen pH-Wert verringert, dies erleichtert die O2-Abgabe in Geweben mit hohem O2-Bedarf (Bohr-Effekt). Auch 2,3-Diphosphoglycerat (Zwischenprodukt der Glycolyse) senkt die O2-Affinität des Hb und stellt so die Sauerstoffversorgung stoffwechselaktiver Gewebe sicher.
Aus der zentralen Funktion des Hb als O2-Transporter erklären sich die vielfältigen Beeinträchtigungen bei gestörter Erythropo(i)ese bzw. Anämie.
Hämoglobin: Strukturvergleich von Myglobin (links) und Hämoglobin. Die zentralen Scheiben zeigen die Anordnung der Häm-Gruppen in den Proteinstrukturen. Hämoglobin
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.