Lexikon der Ernährung: Lebensmittel-Medikamenten-Interaktionen
Lebensmittel-Medikamenten-Interaktionen
Andreas Hahn und Maike Wolters, Hannover
Im menschlichen Organismus können sich nicht nur Nahrungsinhaltsstoffe oder Arzneistoffe untereinander beeinflussen, sondern auch wechselseitig. Die auftretenden Interaktionen sind vielfältig und werden von zahlreichen Einflussgrößen moduliert. Hieraus können je nach zugrundeliegendem Mechanismus beispielsweise Veränderungen der Arzneimittelwirkung oder der Nährstoffversorgung resultieren. In einigen wenigen Fällen, so z. B. bei der Hemmung der Blutgerinnung durch Vitamin-K-Antagonisten wie Marcumar, werden solche Effekte im Sinne einer erwünschten Wirkung genutzt, in der Regel handelt es sich jedoch um unerwünschte Ereignisse, die oft wenig Beachtung finden, aber den Krankheits- bzw. Heilungsverlauf beeinträchtigen oder Nährstoffdefizite hervorrufen können. Das Risiko für Nährstoff-Medikamenten-Interaktionen wird durch einige Faktoren erhöht (Abb. 1).
Insbesondere ältere Menschen laufen Gefahr für solche Interaktionen, da vielfach zahlreiche Medikamente gleichzeitig verwendet werden. Altersbedingte pathophysiologische Veränderungen, hormonelle Störungen sowie Einschränkungen in der Kostzusammenstellung sind bei ihnen gehäuft anzutreffen und tragen dazu bei, dass negative Konsequenzen auftreten. Auch chronisch Kranke und Kinder sind im Hinblick auf Wechselwirkungen zwischen Nahrungs- und Arzneimitteln stärker gefährdet als Erwachsene. Um die Wirksamkeit einer Therapie zu optimieren und unerwünschte Nebenwirkungen der Medikation zu reduzieren, sollten Patienten hinsichtlich möglicher Interaktionen ausführlich beraten werden. In der Praxis findet dieses Thema aber bisher relativ wenig Beachtung.
Grundsätzliche Mechanismen der Interaktionen
Da oral verabreichte Pharmaka die gleichen Stoffwechselwege durchlaufen wie Nährstoffe, kann es auf verschiedenen Ebenen zu Wechselwirkungen kommen. Hierbei sind insbesondere die Digestion und Absorption, aber auch die Verteilung, der Metabolismus, die Wirksamkeit am Wirkort sowie die Ausscheidung von Nahrungsinhaltsstoffen bzw. Pharmaka betroffen. Darüber hinaus können Arzneimittel die Hunger-Sättigungs-Regulation sowie das Geschmacks- und Geruchsempfinden beeinflussen, so dass es zu Appetitverlust, Aversionen und damit einem veränderten Ernährungsmuster kommen kann.
Besonders vielgestaltig zeigen sich die Wechselwirkungen durch Einflüsse auf die Verdauung und Absorption. So spielen neben direkten Reaktionen zwischen Nahrungsbestandteilen und Arzneimitteln weitere Einflüsse im Magen-Darm-Trakt eine Rolle (Abb. 2). Veränderungen der Wirkstoffverteilung ergeben sich u. a. durch Beeinflussung der Proteinbindung oder direkte Wechselwirkungen zwischen Pharmakon und Nahrungsinhaltsstoff. Bei der Metabolisierung von Arznei- und Nahrungsstoffen können wechselseitige Einflüsse auf metabolisierende Enzyme einen beschleunigten oder verzögerten Abbau hervorrufen. Die renale Ausscheidung wiederum kann u. a. durch den pH-Wert und Einflüsse auf die Nierenfunktion verändert werden.
Einfluss von Nahrungsbestandteilen auf die Wirkung von Arzneimitteln
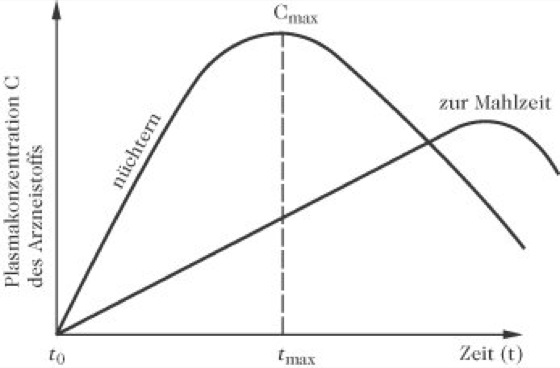
Nahrungsmittel können die Pharmakokinetik und -dynamik von Arzneistoffen gravierend verändern und sich damit entscheidend auf den Erfolg einer Therapie auswirken. Derartige Einflüsse zeigen sich an der Bioverfügbarkeit, die anhand der Fläche unter der Plasmaspiegel-Zeit-Kurve (Earea under the plasma concentration-time curve,AUC) deutlich wird. Veränderungen der Absorptionsgeschwindigkeit durch Nahrung können u. U. zu einem flacheren oder steileren Kurvenverlauf führen und sich damit auf das Erreichen und die Aufrechterhaltung der wirksamen Plasmakonzentration auswirken (Abb. 3).
Die Kenntnisse über Wechselwirkungen sind bei vielen Nahrungsinhaltsstoffen noch unzureichend. Zudem kommen hier auch interindividuelle Unterschiede z. B. durch genetische Polymorphismen zum Tragen, ein Thema, dem die Pharmakogenetik erst langsam Rechnung tragen kann. Eine höhere Empfindlichkeit ist außerdem bei einzelnen Bevölkerungsgruppen wie älteren Menschen oder Kindern zu verzeichnen. So hat die Nahrung bei Erwachsenen z. B. keinen signifikanten Effekt auf die Bioverfügbarkeit von peroral verabreichtem Methotrexat. Bei Patienten mit juveniler rheumatoider Arthritis zeigte sich hingegen eine höhere Bioverfügbarkeit des Cytostatikums Methotrexat bei Einnahme auf leeren Magen. Auch bei dem Thyreostatikum Propylthiouracil ergab sich eine verminderte Verfügbarkeit durch Nahrung bei pädiatrischen Patienten, während bei Erwachsenen nur ein vernachlässigbarer Effekt auftritt. Daneben sind absorptionshemmende Effekte durch Nahrung bei Kindern auch auf das Antiasthmatikum Theophyllin zu erwarten.
Auswirkungen von Nahrung auf die Absorption von Pharmaka
Abgesehen von Ethanol und in geringem Umfang einigen kleinen sauer reagierenden Substanzen, die bereits im Magen absorbiert werden, gelangen saure oder basische Arzneistoffe normalerweise im Dünndarm zur Absorption. Dennoch spielt die Magenfunktion auch für diese Stoffe eine entscheidende Rolle, da die Magenmotilität und Entleerungsrate darüber entscheiden, wie schnell eine Substanz den Dünndarm erreicht. So ließ sich beispielsweise für Paracetamol nachweisen, dass die Magenentleerung der geschwindigkeitsbestimmende Schritt für das Erscheinen der Substanz im Blutplasma ist. Eine verzögerte oder auch beschleunigte Magenentleerung kann somit die Kinetik oral verabreichter Medikamente grundlegend modfizieren, so dass z. B. die notwendigen Wirkspiegel nicht oder nur verzögert erreicht werden.
Grundsätzlich können Nahrungsmittel die Pharmakaabsorption über verschiedene Mechanismen verzögern oder beschleunigen. Gravierende Beeinträchtigungen der Bioverfügbarkeit von Arzneimitteln ergeben sich insbesondere dann, wenn zwischen Pharmakon und Nährstoff schwer lösliche oder unlösliche Komplexe enstehen. So reduziert sich die Bioverfügbarkeit von Tetrazyklinen und Gyrasehemmern bei gleichzeitiger Aufnahme von Milch bzw. Calcium-, Magnesium- oder Eisenionen enthaltenden Nahrungsmitteln durch die Bildung unlöslicher Chelate. Bereits eine kleine Menge Milch im zum Hinunterspülen getrunkenen Kaffee kann die Tetrazyklinabsorption drastisch beeinträchtigen. Auch bei den in der Osteoporosetherapie eingesetzten, ohnehin schlecht oral verwertbaren Bisphosphonaten vermindert Calcium aus der Nahrung die Bioverfügbarkeit. Bei Alendronat reduziert sich die Absorption sogar um 80–90 %, wenn die Substanz bis zu zwei Stunden nach einer Mahlzeit aufgenommen wird. Fettreiche Nahrung erhöht die Bioverfügbarkeit zahlreicher lipophiler Arzneistoffe wie des Diuretikums Spironolacton und des Antimycotikums Ketoconazol. Bekannte Wirkungen von Nahrungsinhaltsstoffen lassen sich zum Teil auch gezielt nutzen. So kann die Einnahme einiger Pharmaka, wie der Antimycotika Itraconazol und Ketoconazol, mit einem säuernden Getränk (z. B. Colagetränke) deren Verfügbarkeit, insbesondere bei Personen mit Hypo- oder Achlorhydrie, verbessern. Demgegenüber reduziert sich die Bioverfügbarkeit des hydrophilen Lipidsenkers Pravastatin mit einer fettreichen Mahlzeit um etwa ein Drittel.
Weitere Beobachtungen deuten auf eine Beeinträchtigung der Pharmakabioverfügbarkeit durch enterale Ernährung. Zwar ergaben sich in randomisierten Studien mit gesunden Probanden keine Effekte auf die Konzentration des Antiepileptikums Phenytoin im Plasma, Beobachtungen an Patienten sprechen jedoch für eine reduzierte Bioverfügbarkeit der Substanz bei enteraler Ernährung im Vergleich zu peroraler Nahrungszufuhr. Die Tabellen 2 und 3 zeigen weitere Beispiele für eine verminderte oder verzögerte bzw. verbesserte oder beschleunigte Arzneimittelabsorption durch Nahrung bzw. Nahrungsinhaltsstoffe.
Effekte auf die Metabolisierung und Pharmakodynamik von Arzneimitteln
Die Metabolisierung von Arzneistoffen basiert im Wesentlichen auf den hepatischen Phase-I- und Phase-II-Reaktionen, die zu einer Inaktivierung und Ausscheidungsfähigkeit des Pharmakons führen. In Phase-I-Reaktionen werden Arzneistoffe oxidiert, hydroxyliert, reduziert oder hydrolisiert, so dass sich Änderungen der funktionellen Gruppe(n) des Moleküls ergeben. Besondere Beachtung gilt hier den mischfunktionellen Oxygenasen im endoplasmatischen Retikulum der Leber, ein induzierbares Enzymsystem, das die Oxidation zahlreicher Arzneistoffe katalysiert. Bei Phase-II-Reaktionen (Konjugationen) werden an die durch Phase-I-Reaktionen geschaffenen funktionellen Gruppen Reste (Glucuron-, Schwefel-, Carbon-, Aminosäuren, Glutathion) gekoppelt, so dass das Molekül in der Regel in eine besser wasserlösliche und damit meist über die Nieren ausscheidbare Verbindung überführt wird. Da für die Metabolisierungsreaktionen verschiedene Substanzen, die u. a. aus der Nahrung stammen, bereitgestellt werden müssen, beeinflussen Lebensmittelauswahl und Ernährungsstatus auch den Arzneistoffmetabolismus. So hemmt eine proteinarme Kost die NADPH-abhängigen Enzyme und vermindert die Phase-I-Biotransformation, während für Phase-II-Reaktionen ausreichend Kohlenhydrate, Aminosäuren und Fette vorhanden sein müssen.
Ein wesentliches Kriterium für die Wirksamkeit eines Arzneimittels ist das Ausmaß des First-Pass-Effektes. Unmittelbar nach der Absorption aus dem Magen-Darm-Trakt passiert ein Pharmakon zunächst über den Pfortaderstrom die Leber und wird hier bereits in unterschiedlichem Umfang extrahiert und metabolisch inaktiviert. Erst im Anschluss an diese Erstpassage der Leber gelangt die Wirksubstanz in den Lungen- und Körperkreislauf. Auch im Lumen oder in der Wand des Gastrointestinaltraktes kann bereits eine Metabolisierung durch Cytochrom-P450-abhängige Monooxygenasen sowie Konjugationsreaktionen erfolgen. Insbesondere bei Substanzen, bei denen der First-Pass-Effekt verhältnismäßig groß ist, kann durch Nahrung bzw. Nahrungsinhaltsstoffe die Bioverfügbarkeit verändert werden. So wird beispielsweise bei den Betablockern Propranolol und Metoprolol der First-Pass-Effekt durch die Nahrung reduziert, da die Substanzen vermutlich bei einem durch die Nahrungsaufnahme gesteigerten hepatischen Blutstrom in geringerem Umfang von der Leber aufgenommen und metabolisiert werden. Auch das Antihypertensivum Hydralazin ist bei Aufnahme zusammen mit Nahrung besser bioverfügbar, da der First-Pass-Effekt in den Darmzellen vermindert wird. Für die genannten Substanzen gilt dies jedoch nicht, wenn sie als slow-release-Formulierungen verabreicht werden. Demgegenüber bewirkt die Nahrungsaufnahme eine verminderte Verfügbarkeit des Neuroleptikums Chlorpromazin, weil die verzögerte Magenentleerung den First-Pass-Metabolismus in den Darmzellen verstärkt.
Besondere Beachtung fand in den letzten Jahren die Tatsache, dass die Aufnahme von Grapefruitsaft zu erhöhten Plasmakonzentrationen vieler peroral eingenommener Arzneimittel führt. Der Effekt basiert auf einer Zerstörung des Cytochrom-P450-Enzyms CYP3A4 in der Darmmukosa durch Inhaltsstoffe des Saftes, so dass der First-Pass-Effekt herabgesetzt wird. Demgegenüber wird das hepatische CYP3A4 erst durch extrem hohe Aufnahmemengen (z. B. 6 Gläser am Tag über mehrere Tage) inhibiert. Die hiermit verbundene Steigerung der Bioverfügbarkeit ist demzufolge umso größer, je ausgeprägter der First-Pass-Effekt bei einer Substanz ist. Die Interaktion hält bis zu 24 Stunden nach Einnahme des Saftes an und wird auf enthaltene Furanocumarinderivate wie 6‘,7‘-Dihydroxybergamottin und das Flavonoid Naringenin zurückgeführt. Neben der CYP3A4-Hemmung wird als Wirkmechanismus für einige Arzneimittel auch eine Veränderung der P-Glycoprotein-Transporter diskutiert. Diese in der intestinalen Bürstensaummembran lokalisierte Pumpe transportiert lipophile Moleküle aus dem Enterocyten zurück in das intestinale Lumen. Zahlreiche lipophile Arzneimittel werden nach Aufnahme in den Enterocyten entweder durch CYP3A4 metabolisiert oder durch den P-Glykoprotein-Transporter zurückgepumpt. Die Tabelle 3 zeigt Beispiele betroffener Arzneimittel. Dabei ist allerdings zu berücksichtigen, dass das Ausmaß der Interaktion sehr variabel ist. Bei Cyclosporin wurden Erhöhungen der Bioverfügbarkeit im Bereich von 5–90 % ermittelt, bei Simvastatin kam es nach hohem Grapefruitsaftkonsum (6 Gläser pro Tag) zu einer Steigerung der Bioverfügbarkeit auf etwa das 15fache. Interindividuelle Unterschiede ergeben sich nicht zuletzt aufgrund der weiten Schwankungsbreite der intestinalen CYP3A4-Konzentration. Zudem ist die unterschiedliche Konzentration des Grapefruitsaftes ein weiterer variabler Einflussfaktor. Das von dieser Interaktion ausgehende Gefahrenpotenzial wird beispielsweise bei dem Antihistaminikum Terfenadin deutlich, dessen Cardiotoxizität sich aufgrund des durch Grapefruitsaft gehemmten Metabolismus stark erhöhen kann. Um in der Praxis eine Aussage über eine mögliche Interaktion mit Grapefruitsaft treffen zu können, wurde vorgeschlagen, grundsätzlich solche Arzneimittel, die nicht mit den Arzneimitteln Itraconazol und Erythromycin zusammen eingenommen werden dürfen, auch nicht mit Grapefruitsaft zu kombinieren. Hintergrund dieser Überlegung ist, dass auch Itraconazol (Antimycotikum) und Erythromycin (Antibiotikum) eine hemmende Wirkung auf CYP3A4 ausüben und sich deshalb bei der Kombination mit anderen Arzneimitteln ein ähnlicher Effekt wie bei Grapefruitsaft ergibt.
Auf einem anderen Mechanismus scheint die bisher nur im Tierversuch festgestellte Beeinträchtigung der Wirksamkeit von Tamoxifen (Östrogenrezepor-Antagonist) durch das in Citrusfrüchten vorkommende Tangeretin zu beruhen. So zeigte sich bei gleichzeitiger Gabe von Tangeretin mit Tamoxifen eine Aufhebung des wachstumshemmenden Tamoxifeneffektes auf Tumorzellen. Da eine Induktion der metabolisierenden Leberenzyme und damit eine Verminderung der Bioverfügbarkeit von Tamoxifen ausgeschlossen werden konnte, wird davon ausgegangen, dass der Effekt auf einer Verminderung der Natürlichen Killerzellen durch Tangeretin basiert.
Da Arzneimittel zum Teil an Plasmaproteine gebunden transportiert werden, spielen auch Effekte eine Rolle, die diese Bindung beeinflussen. Der ungebundene Anteil einer Substanz entfaltet in der Regel eine höhere Wirksamkeit, ist jedoch auch schneller metabolisierbar. Dies wirkt sich beispielsweise bei dem Tranquilizer Diazepam so aus, dass er durch Fette aus seiner Proteinbindung im Blut verdrängt wird und so mehr freies Diazepam vorliegt, woraus sich eine verstärkte Wirksamkeit ergibt. Demgegenüber liegt Chinidin (Antiarrhythmikum) nach einer Mahlzeit vermehrt an Proteine gebunden vor, so dass die Konzentration an ungebundenem und therapeutisch wirksamem Chinidin nur verzögert ansteigt.
Vitamin-B6-reiche Lebensmittel beschleunigen als Kofaktor bei der Decarboxylierung von Aminosäuren die periphere Umwandlung von L-Dopa zu Dopamin, so dass es nur zu einem geringen Teil das Gehirn erreicht. Der Effekt wird jedoch durch gleichzeitige Gabe von nur peripher wirkenden Decarboxylase-Inhibitoren (Carbidopa, Benserazid) verhindert. Durch eine hohe Aufnahme Vitamin-K-reicher Lebensmittel (grünes Blattgemüse, Blumenkohl, Leber) kann die Wirksamkeit von Warfarin beeinträchtigt werden; sie sollten daher weitgehend gemieden werden. Eine weitere Interaktion ergibt sich zwischen Nahrungsproteinen und dem in der Ulcustherapie eingesetzten Sucralfat. Der Wirkmechanismus von Sucralfat basiert darauf, dass es auf der Ulcusoberfläche Komplexverbindungen mit Proteinen bildet, wodurch der Angriff aggressiver Faktoren wie Salzsäure verhindert wird. Diese Wirkung kann jedoch nur in ausreichendem Umfang erfolgen, wenn es nicht schon an gleichzeitig mit der Nahrung aufgenommene Proteine bindet.
Einflüsse von Nahrung auf die Arzneistoffexkretion
Arzneimittel werden entweder unverändert oder in Form ihrer Metaboliten überwiegend renal ausgeschieden. Dabei kann sich der Harn-pH auf die Eliminationsgeschwindigkeit auswirken. So werden bei saurem Harn-pH basische und bei alkalischem Harn-pH saure Arzneimittel schneller gelöst und eliminiert. Eine vegetarische Ernährung oder ein hoher Konsum an Citrussäften führen zu einer Alkalisierung des Harns, so dass beispielsweise Acetylsalicylsäure, Barbiturate und Sulfonamide beschleunigt ausgeschieden werden. Darüber hinaus kann der Wasser- und Elektrolyt-Haushalt die Ausscheidung einiger Arzneimittel beeinflussen. Da die Lithiumausscheidung eng mit der Natriumausscheidung verknüpft ist, kann eine niedrige Natriumaufnahme bei geringer Flüssigkeitszufuhr zu einer Lithiumretention und unerwünschten Überdosierungen führen, während eine hohe Natrium- und Flüssigkeitsaufnahme die Wirksamkeit der als Psychopharmaka eingesetzten Substanz durch eine verstärkte Ausscheidung reduzieren kann.
Wirkungen von Pharmaka auf die Nährstoffversorgung
Eine Reihe von Pharmaka kann in unterschiedlichem Ausmaß den Nährstoffstatus vermindern und damit im Extremfall zu klinischen Nährstoffmangelerscheinungen führen. Während ein manifester klinischer Mangel in westlichen Industrienationen aber eher selten ist, treten vielfach subklinische Anzeichen einer Unterversorgung wie unspezifische Befindlichkeitsstörungen auf, die das Wohlbefinden des Patienten beeinträchtigen und bei entsprechender Intervention vermeidbar wären. Bei Nährstoffen, für die der Organismus ausgeprägte Speicher besitzt, wie Vitamin A oder Vitamin B12, kommt es erst verzögert zu Mangelerscheinungen, da eine längere Zeit unzureichender Zufuhr überbrückt werden kann. Demgegenüber kann sich bei wasserlöslichen Vitaminen, wie Thiamin, Riboflavin, Pyridoxin und Folsäure, die nur latent in ihrer als Coenzym wirksamen Form retiniert werden, innerhalb weniger Wochen oder Monate eine Unterversorgung zeigen.
Grundsätzlich wächst die Gefahr eines therapiebedingten Nährstoffmangels mit dem Potenzial des Arzneimittels, in die Nährstoffversorgung einzugreifen, mit der Dauer der Applikation und der Höhe der Dosis sowie mit einer bereits zu Therapiebeginn schlechten Nährstoffversorgung des Patienten oder einem stark erhöhten Nährstoffbedarf. Arzneimittelbedingte Mangelerscheinungen können sich insbesondere dann rasch entwickeln, wenn es bereits zur weitgehenden Entleerung der Nährstoffspeicher gekommen ist, z. B. infolge einer Erkrankung, durch Wachstumsphasen oder durch eine Schwangerschaft. Darüber hinaus bestehen genetische Unterschiede in der Enzymaktivität verschiedener Individiuen, die zu einer unterschiedlichen Metabolisierungsgeschwindigkeit führen und dementsprechend auch das Auftreten von Interaktionen entscheidend beeinflussen können. Neben anderen genetischen Polymorphismen fielen interindividuelle Unterschiede bei der N-Acetyltransferase auf. Die Prävalenz langsamer Metabolisierer ist bei der N-Acetyltransferase (NAT2) besonders hoch (40–70 %), was sich beispielsweise auf die Metabolisierung des Antituberkulotikums Isoniazid deutlich auswirkt. Langsam-Acetylierer bilden vermehrt Oxidationsprodukte von Isoniazid, was zu einer erhöhten Hepatotoxizität führt. Zudem kommt es bei ihnen durch aus Isoniazid abgespaltenem Hydrazin zu einer verstärkten Inaktivierung von Pyridoxin und damit häufiger zu neurologischen Störungen.
Einfluss von Arzneimitteln auf den Appetit und die Hunger- und Sättigungs-Regulation
Zahlreiche Pharmaka verursachen Übelkeit, Erbrechen sowie Schleimhautschädigungen und können so zu einer gravierenden Einschränkung der Nahrungsaufnahme führen. Treten diese Nebenwirkungen nur kurzfristig zu Beginn der Therapie auf, sind sie von untergeordneter Bedeutung. Problematischer ist die längerfristige Einschränkung der Nahrungsaufnahme, z. B. bei Verabreichung von Zytostatika, herzwirksamen Glycosiden oder bei dauerhafter Einnahme von nichtsteroidalen Antiphlogistika. Eine Appetitminderung wurde auch bei Gabe von Digitalispräparaten beobachtet, während eine Beeinträchtigung von Geruchs- und Geschmackssinn nach Allopurinolgaben zur Gichtbehandlung sowie als sekundäre Folge eines Zinkmangels auftritt. Darüber hinaus kann die u. a. durch Sedativa, Anticholinergika und Hypnotika induzierte Verminderung der Speichelsekretion zu Schluckbeschwerden, vermindertem Geschmacksempfinden und damit einer reduzierten Nahrungsaufnahme führen.
Auf der anderen Seite sind auch appetitsteigernde Wirkungen durch Pharmaka möglich. Dies gilt insbesondere für Psychopharmaka, die über eine Einwirkung auf übergeordnete Zentren der Hunger-Sättigungs-Regulation die Nahrungsaufnahme erhöhen oder eine Veränderung des Ernährungsmusters hervorrufen und u. U. das Risiko für Adipositas verstärken können. Diese Effekte resultieren aus einer Einwirkung der Pharmaka auf die Konzentration der Catecholamine und der biogenen Amine Dopamin und Serotonin im synaptischen Spalt. Beispiele für appetitsteigernde Pharmaka sind Neuroleptika vom Phenothiazin-Typ, tricyclische Antidepressiva (z. B. Imipramin, Clomipramin, Amitryptilin), Tranquillantien wie die Benzodiazepine, Lithiumsalze sowie Monoaminooxidasehemmstoffe. Die Serotoninantagonisten Pizotifen und Cyproheptadin besitzen einen stark appetitsteigernden Effekt und werden daher nicht nur zur Migräneprophylaxe und als Antiallergika verabreicht, sondern auch als appetitanregende Mittel eingesetzt.
Arzneimittelbedingte Veränderungen im Gastrointestinaltrakt
Im Magen-Darm-Trakt ergeben sich vielfältige Pharmaka-Nährstoff-Wechselwirkungen, die die Nährstoffversorgung insgesamt oder auch einzelne Nährstoffe betreffen können (Tab. 4). Insbesondere Veränderungen der Passagezeit bis hin zu Diarrhöen können die Nährstoffausnutzung gravierend beeinträchtigen, da die Verweildauer bzw. die Kontaktzeit der Nährstoffe mit den resorbierenden Darmzellen für eine effiziente Absorption nicht ausreicht. Eine Erhöhung des pH-Wertes durch Antazida oder H2-Blocker verringert die Absorption der Nährstoffe, die bevorzugt bei niedrigem pH-Wert aufgenommen werden, wie z. B. Folsäure. Zudem wird die Folsäureabsorption auch durch andere Pharmaka vermindert, da die in der Nahrung hauptsächlich vorliegenden Polyglutamylformen der Folsäure zunächst mit Hilfe von spezifischen Polyglutamathydrolasen zu den entsprechenden Folsäuremonoglutamaten hydrolisiert werden müssen. Diese werden in ihrer Aktivität jedoch durch orale Kontrazeptiva, Sulfasalazin und die Antiepileptika Primidon, Phenytoin und Carbamazepin gehemmt.
Einflüsse auf Nährstoffdistribution, -metabolisierung und -ausscheidung
Die Verteilung der Nährstoffe kann ebenfalls über unterschiedliche Mechanismen durch Arzneimittel beeinträchtigt werden. So reagieren die Antituberkulotika Isoniazid und Cycloserin mit der Aldehydgruppe von Pyridoxal bzw. Pyridoxalphosphat unter Bildung einer Schiffschen Base, so dass Vitamin B6 hierdurch inaktiviert und verstärkt ausgeschieden wird. Dies führt bei etwa 40 % der behandelten Patienten zu peripheren Polyneuropathien als Folge eines Vitamin-B6-Mangels. Eine Prophylaxe durch die gleichzeitige Gabe von Pyridoxin ist möglich. Da im Vitamin-B6-Mangel auch die pyridoxalphosphatabhängige Bildung von Niacin aus Tryptophan vermindert ist, kann zudem ein Niacinmangel resultieren. Auch das Cytostatikum Procarbazin interagiert mit Vitamin B6, worauf seine neurotoxische Wirkung zurückgeführt wird. Von eher untergeordneter physiologischer Bedeutung scheint hingegen die Verdrängung von Folsäure und Ascorbinsäure aus der unspezifischen Bindung an Plasmaproteine durch Acetylsalicylsäure.
Einflüsse auf die Metabolisierung von Nährstoffen, aber auch Arzneistoffen, ergeben sich insbesondere durch Pharmaka, die zu einer Induktion fremdstoffmetabolisierender Leberenzyme führen. So erhöhen die Antiepileptika Phenobarbital und Phenytoin, das Antituberkulotikum Rifampicin sowie das Antimykotikum Griseofulvin innerhalb weniger Tage die Aktivität mikrosomaler Monooxygenasen. Dies führt nicht nur zu einem beschleunigten Abbau von Arzneimitteln, sondern kann auch die Metabolisierung von Nährstoffen beschleunigen. Dementsprechend ist bei Epileptikern, die dauerhaft Phenytoin einnehmen, der Vitamin-D-Abbau verstärkt und hierdurch die intestinale Calciumaufnahme reduziert. In der Folge treten bei 10 bis 30 % dieser Patienten Hypocalcämien und in seltenen Fällen Osteomalazie auf.
Von physiologischer Bedeutung ist außerdem die Interaktion des biogenen Amins Tyramin mit Monoaminoxidase-Hemmstoffen (MAO-Hemmstoffe). Die Hemmung des Tyraminabbaus durch diese Psychopharmaka kann zum Blutdruckanstieg bis hin zu hypertonen Krisen führen. Daher müssen bei Einnahme des unselektiven Tranylcypromin, das sowohl die Monoaminoxidasen A und B irreversibel hemmt, tyraminreiche Nahrungsmittel wie Käse, Schokolade, Wein und Avocado gemieden werden. Demgegenüber ist bei Verabreichung des selektiven Monoaminoxidase-A-Blockers Moclobemid keine Diät erforderlich, da für den Tyramin-Abbau die Monoaminoxidase B noch zur Verfügung steht und höhere Tyramin-Konzentrationen Moclobemid zudem von der Monoaminoxidase A vedrängen können.
Diuretika erhöhen entsprechend ihrer Indikation die Wasser- und Elektrolytausscheidung. Eine bedeutende Nebenwirkung von Schleifendiuretika und Thiaziden ist der Verlust an Kaliumionen. Während Thiazide darüber hinaus die Magnesiumausscheidung steigern, führen Schleifendiuretika vom Furosemid-Typ auch zu einer verstärkten Calciumionen-Ausscheidung. Gleichermaßen kann bei zahlreichen Diuretika ein Absinken des Zinkspiegels beobachtet werden. Daneben besteht die Gefahr einer Interaktion mit der renalen Nährstoffausscheidung bei allen Arzneimitteln, die die Nierenfunktion beeinträchtigen. Hierzu gehören beispielsweise das Antibiotikum Gentamicin und das Cytostatikum Cisplatin. Zu erhöhten Nährstoffverlusten über die Fäzes kommt es insbesondere nach der Gabe von Laxanzien, die mit Ausnahme der Quellstoffe bei langfristiger Anwendung zu Elektrolytstoffwechselstörungen, insbesondere zum Kaliumverlust, führen. Eine Erhöhung der Ausscheidung von Nährstoffen ergibt sich zudem zwangsläufig bei den bereits aufgeführten Schädigungen der enteralen Schleimhaut, die zu einer gesteigerten Ausscheidung von Eisen und anderen Spurenelementen sowie zu Proteinverlusten führen.
Hemmung der Nährstoffwirkung durch Arzneimittel
Eine erwünschte Hemmung der Nährstoffwirkung am Wirkort stellt das therapeutische Prinzip einiger Pharmaka wie des Folsäureantagonisten Methotrexat und der Vitamin-K-Antagonisten Warfarin und Phenprocoumon dar. Demgegenüber ist eine geringfügig folsäureantagonistische Wirkung beim Menschen durch das bakteriostatisch wirksame Trimethoprim und das Antiprotozoenmittel Pyrimethamin unerwünscht. Da diese spezifisch die Dihydrofolsäurereduktase der empfindlichen Erreger hemmen und die Affinität zum entsprechenden Enzym bei Säugern gering ist, wird allerdings davon ausgegangen, dass sie den Folsäurestoffwechsel des Menschen kaum beeinflussen. Die schwach Folsäure-antagonistische Wirkung des Diuretikums Triamteren, das ebenfalls eine folsäureähnliche Struktur aufweist, kann insbesondere bei prädisponierten Patienten (z. B. mit schwerer Leberzirrhose) zu einer megaloblastären Anämie führen.
Fazit
Arzneimittel und Nährstoffe beeinflussen sich auf unterschiedlichen Wegen wechselseitig, wobei die deutlichsten Effekte auf der Ebene der Absorption und des First-Pass-Metabolismus auftreten. Negative Konsequenzen dieser Interaktionen können prinzipiell jeden Menschen betreffen, der ein Arzneimittel erhält. Ein besonderes Augenmerk ist jedoch auf Risikogruppen zu richten, wie ältere Menschen, chronisch Kranke mit multipler Medikation sowie Kinder. Das Pharmaka-Nährstoff-Interaktionen nicht zu unterschätzen sind, zeigen die gravierenden Effekte von Grapefruitsaft auf die Metabolisierung bestimmter Arzneimittel. Grundsätzlich sollten vor dem Verschreiben eines langfristig einzunehmenden Medikamentes sowohl der Ernährungsstatus eines Patienten als auch die bereits regelmäßig verwendeten Arzneimittel ermittelt werden, um eine Risikoabschätzung zu potenziellen Nährstoffdefiziten und Arzneimittel-Medikamenten-Interaktionen zu ermöglichen. Neue Erkenntnisse hinsichtlich Wechselwirkungen und Nebenwirkungen müssen in die Patienteninformation einfließen. Darüber hinaus besteht weiterer Forschungsbedarf, um unwerwünschte Wirkungen zu charakterisieren und darüber informieren zu können.
Weiterführende Literatur
D. Fleisher, C. Li, Y. Zhou, L.-H. Pao, A. Karim: Drug, meal and formulation interactions influencing drug absorption after oral administration. Clin. Pharmacokinet. 36 (1999) 233–254.
A. Hahn: Medikamenteneinnahme und Nährstoffversorgung. I. Prinzipien und Mechanismen. Ernährungs-Umschau 42 (1995) 198–207.
A. Hahn: Medikamenteneinnahme und Nährstoffversorgung. II. Einflußfaktoren und Konsequenzen. Ernährungs-Umschau 42 (1995) 238–242.
G.C. Kane u. J.J. Lipsky: Drug-grapefruit juice interactions. Mayo Clin. Proc. 75 (2000) 933–942.
D.A. Maka u. L.K. Murphy: Drug-nutrient interactions: a review. AACN Clin. Issues 11 (4) (2000) 580–589.
B.N. Singh: Effects of food on clinical pharmacokinetics. Clin. Pharmacokinet. 37 (1999) 213–255.
J.A. Thomas u. R.A. Burns: Important drug-nutrient interactions in the elderly. Drugs Aging 13 (3) (1998) 199–209.
J.A. Thomas: Drug-Nutrient Interactions. Nutr. Rev. 52 (10) (1995) 271–282.
Lebensmittel-Medikamenten-Interaktionen: Abb. 1. Risikofaktoren für Nährstoff-Pharmaka-Interaktionen.
|
Lebensmittel-Medikamenten-Interaktionen: Abb. 2. Faktoren mit Einfluss auf die Bioverfügbarkeit von Arznei- und Nahrungsstoffen im Gastrointestinaltrakt.
|
Lebensmittel-Medikamenten-Interaktionen: Abb. 3: Plasmaspiegel-Zeit-Kurven am Beispiel eines durch Nahrung verzögert absorbierten Arzneimittels bei nüchterner Einnahme und Einnahme mit Nahrung. Lebensmittel-Medikamenten-Interaktionen
Lebensmittel-Medikamenten-Interaktionen: Tab. 1: Beispiele für eine verminderte oder verzögerte Arzneimittelabsorption durch die Nahrung.
| ||
| Bildung unlöslicher Komplexe mit zweiwertigen Kationen, v. a. Ca2+, Fe2+ (Milch, Fleisch) | Tetrazykline; Gyrasehemmer (z. B. Ciprofloxacin, Floxacin, Enoxacin, Norfloxacin, Lomefloxacin) | |
| Bildung unlöslicher Komplexe mit Schwarztee | basische stickstoffhaltige Neuroleptika und Antidepressiva (z. B. Maprotilin, Imipramin, Clomipramin, Lofepramin) | |
| verzögerte Magenentleerung führt zum Abbau säurelabiler Substanzen im Magen | Erythromycin (Antibiotikum); β-Laktam-Antibiotika | |
| erhöhter Magen-pH vermindert Löslichkeit und Absorption | Isoniazid (Antituberkulotikum); Indinavir (Virostatikum); Penicillin VK | |
| Nahrung verhindert Zutritt zur Mucosa (mechanische Barriere) | Azithromycin und Sulfonamide (Antibiotika); Atenolol (β-Blocker) | |
| herabgesetzte Verfügbarkeit durch Ballaststoffe | Paracetamol; HMG-CoA-Reduktase-Hemmer (z. B. Lovastatin); Thyroxin; Digoxin (Digitalis-Glycosid) | |
| kompetitive Hemmung der Absorption durch proteinreiche Nahrung | L-Dopa (Anti-Parkinson-Mittel); Methyldopa (Antihypertonikum) | |
| verlangsamte Absorption durch verzögerte Magenentleerung | Zidovudin (AZT, [antiretrovirales Virostatikum]); Sulfonamide | |
| Absorption beeinträchtigt, Mechanismus unbekannt | Lincomycin (Antibiotikum); Rifampicin (Antituberkulotikum) | |
| verzögerter Wirkungseintritt durch Nahrung | Valproinsäure (Antiepileptikum); Cortisol, Captopril (Antihypertensivum); Acetylsalicylsäure (Einnahme von Acetylsalicylsäure auf leeren Magen nicht empfehlenswert) |
Lebensmittel-Medikamenten-Interaktionen: Tab. 2: Beispiele für eine erhöhte oder beschleunigte Arzneimittelabsorption durch die Nahrung.
| ||
| verzögerte Magenentleerung, dadurch verbesserte Löslichkeit und Absorption | Spironolacton, Hydrochlorothiazid (Diuretika); Lovastatin (HMG-CoA-Reductase-Hemmer); Phenytoin (Antiepileptikum); Erythromycin (Antibiotikum) | |
| verbesserte Absorption durch fettreiche Nahrung bzw. erhöhte Gallensäurensekretion | Griseofulvin (Antimycotikum); Dic(o)umarol (Vitamin-K-Antagonist); Phenytoin (Antiepileptikum); Theophyllin (Bronchospasmolytikum); Ketoconazol (Antimycotikum); Halofantrin (Malariamittel); Diazepam (Tranquilizer); Carbamazepin (Antiepileptikum) | |
| Absorptionssteigerung mit proteinreicher Nahrung, vermutlich durch Stimulation des für die Absorption verantwortlichen Aminosäurentransporters | Gabapentin (Antiepileptikum) | |
| erhöhte Absorption in Verbindung mit Kohlenhydraten und unlöslichen Ballaststoffen | L-Dopa (Anti-Parkinson-Mittel) |
Lebensmittel-Medikamenten-Interaktionen: Tab. 3. Arzneimittel, die nicht ohne entsprechende Unterweisung mit Grapefruitsaft eingenommen werden sollten
| ||
| Calciumkanalblocker | Felodipin Nimodipin Nisoldipin Nitrendipin | |
| Immunsuppressiva | Cyclosporin Tacrolimus | |
| HMG-CoA-Reduktase-Hemmer | Atorvastatin Lovastatin Simvastatin | |
| Antihistaminika | Ebastin Terfenadin | |
| Psychopharmaka | Buspiron Carbamazepin Diazepam Midazolam Triazolam | |
| Prokinetika | Cisaprid | |
| andere | Methadon (Opioid- Analgetikum) Sildenafil (Viagra®) |
Lebensmittel-Medikamenten-Interaktionen: Tab. 4. Die Nährstoffversorgung beeinflussende Auswirkungen von Pharmaka auf den Magen-Darm-Trakt (ausgewählte Beispiele).
| |||
| veränderte gastrointestinale Motilität / Diarrhö | alle Nährstoffe, insbesondere Mineralstoffe | Laxanzien, Metoclopramid (Prokinetikum), Anticholinergika, Antibiotika, Methyldopa | |
| Hemmung / Inaktivierung von Verdauungsenzymen | Fette, Proteine, Kohlenhydrate, Folsäure | Sulfonamide, Diuretika, orale Kontrazeptiva, Antikonvulsiva, Orlistat (Lipase-Hemmer) | |
| Bindung von Gallensäuren | Fette, fettlösliche Vitamine | Lipidsenker Colestipol, Colestyramin; Antibiotikum Neomycin | |
| Bildung schwerlöslicher Pharmaka-Nährstoff-Komplexe | Mineralstoffe, bes. Fe, Cu, Zn, einige Vitamine | Al- oder Mg-hydroxid haltige Antacida, Tetracycline (Antibiotika) | |
| Lösung der Nährstoffe | fettlösliche Vitamine | mineralölhaltige Laxanzien | |
| Verschiebung des pH-Wertes | Folsäure, Vitamin B12 | Antacida, H2-Blocker | |
| Störung des enteralen Metabolismus | Folsäure | Methotrexat (Cytostatikum); Phenytoin (Antiepileptikum); Sulfasalazin (Therapeutikum bei Crohn-Krankheit und Colitis ulcerosa) | |
| Zerstörung der intestinalen Flora | intestinale Synthese von Vitamin K, Biotin | verschiedene Antibiotika wie Neomycin, Tetracycline | |
| selektive Interaktionen mit dem Nährstofftransport | Vitamin B12, Biotin | Antidiabetikum Metformin; Antiepileptika wie Carbamazepin, Primidon | |
| Schädigung der Darmschleimhaut | alle Nährstoffe; Gefahr von Eisenverlusten durch Blutungen | Analgetika wie ASS, Indometacin, Diclofenac; Mitosehemmstoffe z. B. Colchicin; Cytostatika wie Methotrexat, Actinomycine; Antibiotika wie Neomycin |
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.