Lexikon der Ernährung: Muskelzellen
Muskelzellen, Myocyten, Emuscle cells, im weiteren Sinne die zellulären Grundelemente aller Muskeltypen (Herzmuskel, glatte Muskulatur, quergestreifte [Skelett-]Muskulatur). Letztere bilden einen als Muskelfaser bezeichneten Zellverband.
M. zeigen zahlreiche Spezialisierungen, welche sich auch in besonderen Bezeichnungen des zellulären Feinbaus äußern (Cytoplasma: Sarcoplasma; Plasmamembran: Sarcolem; endoplasmatisches Reticulum: sarcoplasmatisches Reticulum).
Funktion: Charakteristisches Merkmal der M. sind die kontraktilen Muskelproteine, auf Grund derer der Muskel chemische Energie (aus ATP) in Bewegungsenergie (und Wärme) umwandelt. Beim Erwachsenen befinden sich etwa 60 % des Körpereiweißes (also ca. 6 kg) in der Muskulatur, womit diese einen bedeutenden Proteinspeicher darstellt. Diese Proteine können bei erhöhtem Bedarf bzw. zu geringer Zufuhr mit der Nahrung proteolytisch als Aminosäuren mobilisiert oder über die Gluconeogenese energetisch verwertet werden (Cori-Zyklus, Glucose-Alanin-Zyklus).
Auf einen Nervenimpuls hin werden im sarcoplasmatischen Reticulum der gestreiften Muskulatur gespeicherte Calcium-Ionen freigesetzt, so dass deren Konzentration im Sarcoplasma stark ansteigt. Ca2+ hebt eine Blockade der kontraktilen Proteine der M. auf, so dass der Muskel sich kontrahieren kann. In M. der glatten Muskulatur wirkt ebenfalls Ca2+ aktivierend, jedoch unterscheidet sich der Mechanismus und es ist Calmodulin beteiligt. In beiden Muskeltypen führt also eine hohe Calcium-Konzentration im Sarcoplasma zur Kontraktion, eine niedrige Konzentration zur Erschlaffung (Relaxation).
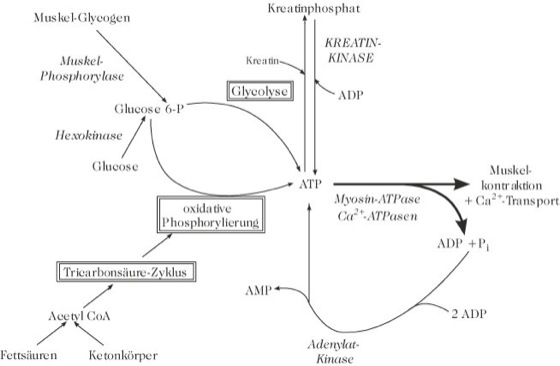
Stoffwechsel: Energieverbrauchend sind sowohl die Bewegungsabläufe der Muskeproteine als auch die Regulation der Calciumkonzentrationen in den Kompartimenten der M., welche durch ATP-getriebene Ionenpumpen erfolgt. Hierfür kann die M. verschiedene ATP-Quellen nutzen (Abb.):
Herzmuskelzellen decken Ihren Energiebedarf ausschließlich durch aerobe Verwertung von Fettsäuren, Ketonkörpern und Glucose (aus dem Blut).
Die Regeneration des verbrauchten ATPs in der M. erfolgt darüber hinaus durch das Enzym Kreatin-Kinase aus in der Zelle gespeichertem Kreatinphosphat.
Der Abbau der verzweigtkettigen Aminosäuren Leucin und Isoleucin erfolgt vor allem in M., trägt jedoch nicht wesentlich zu deren Energieversorgung bei.
Muskelzellen: ATP-Quellen der Muskelzelle. [n. G. Rehner u. H. Daniel, Biochemie der Ernährung, Spektrum Akademischer Verlag, Heidelberg, 1999] Muskelzellen
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.