Lexikon der Ernährung: optische Isomerie
optische Isomerie, Spiegelbildisomerie, Eoptical isomerism, die Eigenschaft eines Paares von Enantiomeren (= Spiegelbild-Isomere), die ein asymmetrisches C-Atom (C*) oder ein anderes chirales Zentrum (Asymmetriezentrum; Chiralität) besitzen, die Schwingungsebene von linear polarisiertem Licht um einen von der Verbindung abhängigen Winkel nach links bzw. nach rechts zu drehen, d. h. optische Aktivität zu zeigen. Das Enantiomer, das die Schwingungsebene nach links dreht wird mit (–), und das welches sie um den gleichen Betrag nach rechts dreht mit (+) gekennzeichnet. Eine Mischung gleicher Anteile beider Enantiomere einer Verbindung heißt Racemat. Die o. I. ist eine Form der Konfigurationsisomerie.
Optische Isomere mit mehr als einem asymmetrischen C-Atom, die sich nicht wie Bild und Spiegelbild verhalten, nennt man Diastereomere (eine Sonderform der Diastereomerie stellen die Epimere dar). In einem Molekül mit zwei chiralen Zentren gibt es insgesamt vier Isomere (RR-, SR-, RS- u. SS-Isomere). Am Beispiel von 2,3-Dichlorpentan (Abb. 1) erkennt man zwei Enantiomerenpaare (RR/SS u. RS/SR) und vier Diastereomerenpaare (SS/SR, RR/RS, SS/RS u. RR/SR). „R“ und „S“ kennzeichnen die absolute Konfiguration an einem chiralen C-Atom (C*). Bei der Bestimmung nach den CIP-Regeln, werden die vier Substituenten am C* so geordnet, dass eine Prioritätenfolge eintritt. Anhand einer dreidimensionalen Darstellung (Keilstrichformel) mit dem Liganden niedrigster Priorität hinten, kann auf der Papierebene eine Rechtsschraube (R-Konfiguration) bzw. eine Linksschraube (S-Konfiguration) vom Liganden höchster zum Liganden niedrigster Priorität gezeichnet werden.
Opt. Isomere, bei denen in der Fischer-Projektion die Hydroxyl-Gruppe (OH-) am von der Aldehyd- bzw. Ketogruppe entferntesten chiralen C-Atom (C*) rechts liegt, werden mit dem Buchstaben D- (von lat. dexter = rechts) und die bei denen sie links liegt mit dem Buchstaben L- (von lat. laevus = links) gekennzeichnet. Bei den Aminosäuren ist die Lage der Aminogruppe (NH2-) für die D/L-Zuordnung maßgeblich. In der Natur kommt vorwiegend die D-Form vor.
Achtung: Die Konfigurationsbezeichnungen „D“ und „L“ sowie „R“ und „S“ dürfen nicht mit der (+) und (–)-Kennzeichnung für die optische Drehungsrichtung verwechselt werden. Genausowenig darf die „D-“ und „L-“Kennzeichnung mit der „R-“ und „S-“Kennzeichnung verwechselt werden. Bei Zuckern ist jedoch die D-Form auch immer die R-Form und die L-Form immer die S-Form.
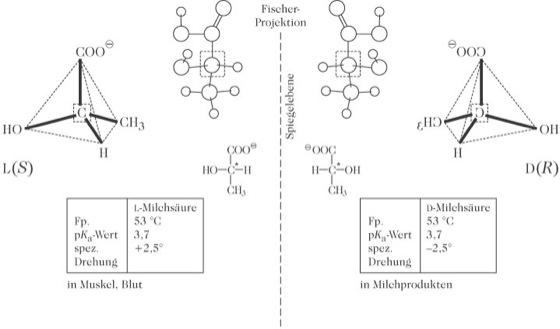
Opt. Isomere haben mit Ausnahme der optischen Drehrichtung und der Reaktion mit anderen chiralen Molekülen gleiche chemische und physikalische Eigenschaften (z. B. Siede- und Schmelzpunkt, Löslichkeit). Ihre physiologischen Eigenschaften, z. B. ihre pharmakologische und toxikologische Wirkung, ihre Reaktion mit Enzymen oder ihre sensorischen Eigenschaften unterscheiden sich jedoch z. T. erheblich. Ein typisches Beispiel dafür ist die rechts- und linksdrehende Milchsäure (Abb. 2). Sie kann zwei verschiedene Formen einnehmen, die sich wie Bild und Spiegelbild, also wie Enantiomere verhalten. Die L(+)-Milchsäure (rechtsdrehend) kommt im Körper vor. Sie kann aus Pyruvat, dem Endprodukt der Glycolyse, entstehen und von der Leber leicht umgesetzt werden. Sie wird auch von den bei der Jogurtherstellung verwendeten Milchsäurebakterien (Streptococcus thermophilus zu 100 %, vom Lactobacillus acidophilus zu 50 %) und von bestimmten Bifidus-Bakterien zu 95 % gebildet. Die D(–)-Milchsäure (linksdrehend) wird ebenfalls von Mikroorganismen produziert und kommt in Sauermilchprodukten, die z. B. mit Lactobacillus bulgaricus hergestellt wurden, vor. Sie kann im menschlichen Organismus nur langsam abgebaut und ausgeschieden werden. Bei einem hohen Verzehr dieser Milchsäure kann es deshalb zu einer Übersäuerung des Blutes kommen. Die WHO empfiehlt deshalb, täglich nicht mehr als 100 mg linksdrehende Milchsäure pro kg Körpergewicht aufzunehmen, also nicht mehr als 1 kg Jogurt. Säuglingen sollte man keine Sauermilchprodukte mit linksdrehender Milchsäure vor Ende des ersten Lebensjahres verabreichen.
Optische Isomerie: Abb. 1. Vier Isomere des Dichlorpentans CH3–CH2–C*HCl–C*HCl–CH3 getrennt durch eine Spiegelebene. Enantiomerenpaare sind die Isomere 1 und 2 bzw. 3 und 4. Diastereomere sind die Isomere 1 und 3, 2 und 4, 1 und 4 sowie 2 und 3. Optische Isomerie

Optische Isomerie: Abb. 2. L- und D- Milchsäure. Optische Isomerie
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.