Lexikon der Ernährung: Phosphoinositol-Kaskade
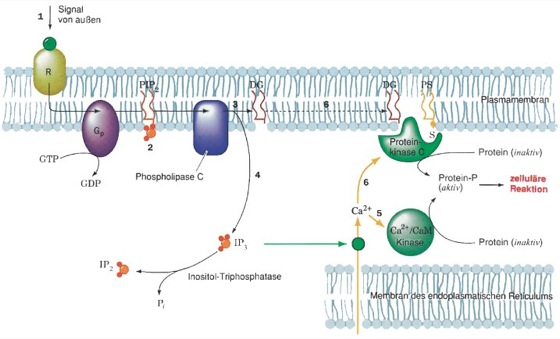
Phosphoinositol-Kaskade, Einositol phosphate cascade, ein wichtiges Signaltransduktionssystem für zahlreiche Hormone, das durch rezeptorvermittelte Hydrolyse von Phosphatidylinositoldiphosphat (PIP2) zwei sekundäre Botenstoffe erzeugt (vgl. Phosphatidylinositole). Die Wechselwirkungen zwischen dem Hormon und Rezeptor werden über ein G-Protein (GTP bindendes Protein) weitergeleitet und aktivieren die membrangebundene Phospholipase C, die die Hydrolyse von PIP2 zu IP3 und DAG katalysiert (Abb.). Das wasserlösliche IP3 wandert zum endoplasmatischen Reticulum und bewirkt dort als sekundärer Botenstoff die Freisetzung von Ca2+ aus intrazellulären Speichern in das Cytosol. Ca2+-Ionen stimulieren direkt oder über Calmodulin verschiedene biochemische Vorgänge (Glycogenolyse, Exocytose, Kontraktion glatter Muskeln u. a.).
Die Lebensdauer des IP3 beträgt nur wenige Sekunden. Es wird zu Inositol abgebaut oder zum Inositol-1,3,4,5-tetrakisphosphat phosphoryliert. Der zweite sekundäre Bote, das unpolare DAG bleibt membrangebunden und aktiviert dort die Protein-Kinase C (PKC); diese wiederum phosphoryliert und reguliert verschiedene andere Proteine. Für die Aktivierung der PKC sind Phosphatidylserin (PS) und Ca2+-Ionen essenziell. Der ebenfalls schnelle Abbau des zweiten Boten DAG führt entweder zu Glycerin und den zugrunde liegenden Fettsäuren, wobei Arachidonsäure als Vorstufe für weitere Signalmoleküle (u. a. Prostaglandine) dient, oder es wird zur Phosphaditsäure phosphoryliert.
Phosphoinositolkaskade.: Bedeutung von PIP2 bei der Signalübertragung in der Zelle im Rahmen der Phosphoinositolkaskade. (1) Wenn ein Agonist an einen Oberflächenrezeptor R bindet, wird über das G-Protein (2) die Phosphorylase C aktiviert, die dann ihrerseits die Hydrolyse von PIP2 zu Inositoltriphosphat (IP3) und Diacylglycerin (DG) katalysiert (3). Das wasserlösliche IP3 sorgt für die Freisetzung von Ca2+, das im endoplasmatischen Reticulum gespeichert ist (4), dieses aktiviert dann u. a. über Calmodulin weitere Vorgänge in der Zelle (5). Das unpolare DG bleibt mit der Membran verbunden und aktiviert dort die Protein-Kinase C, die mehrere Zellproteine phosphoryliert (6) und so deren Aktivität beeinflusst. Phosphoinositolkaskade.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.