Lexikon der Ernährung: Riboflavin
Riboflavin, Vitamin B2, Lactoflavin, (veralt. Vitamin G, Antigrauhaarfaktor, Antidermatitisfaktor), Eriboflavin, vitamin B2, Trivialname für 7,8-Dimethyl-10-(1’-D-ribityl)isoalloxazin (Abb. 1) aus der Gruppe der wasserlöslichen Vitamine.
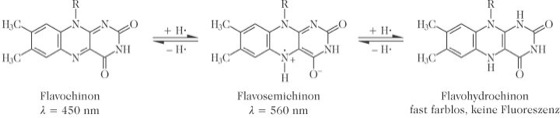
Eigenschaften: R. ist wasserlöslich (10 mg / dl). Wässrige Lösungen von Riboflavin, FMN und FAD sind gelb (λmax= 445 nm). R. ist lichtempfindlich, photochemischer Abbau führt zu Lumiflavin und Lumichrom. In neutralem oder saurem Milieu ist es thermostabil. Flavine bilden ein Redoxsystem (Abb. 2).
Vorkommen: R. liegt in der Natur größtenteils in Form von Flavinmononucleotid (FMN) und Flavinadenindinucleotid (FAD) proteingebunden vor (Abb. 1.). Hohe Gehalte haben Milch und Milchprodukte (0,18–0,50 mg%), Fleisch (0,25 mg%), Leber (3,2 mg%), Fisch (bis 0,35 mg%), Weizenkeime (0,72 mg%), Hülsenfrüchte (bis 0,3 mg%), Nüsse (bis 0,6 mg%) und Pilze (bis 0,45 mg%). Mittlere Gehalte findet man in Brot (0,1–0,8 mg%), Getreideprodukten (0,15 mg%) und div. Gemüse (bis 0,2 mg%). Die Zubereitungsverluste betragen etwa 20 %, die körpereigenen Reserven reichen für 2–6 Wochen.
Bedarf (nach DGE): Die von den DACH-Fachgesellschaften empfohlene tägliche R.-Zufuhr zeigt die Tab. Der Bedarf steigt mit der körperlichen Aktivität, im Rahmen des sog. Postaggressions-Syndroms, bei Alkoholismus und unter dem Einfluss versch. Medikamente (s. a. Essay: Lebensmittel-Medikamenten-Interaktion).
Resorption, Metabolismus: R. wird im proximalen Dünndarm über einen spezifischen, sättigbaren aktiven Transportmechanismus aufgenommen (max. 25 mg / d). Die proteolytische Aktivität des Darmlumens ermöglicht die Abspaltung von FMN und FAD vom Protein und mit Hilfe verschiedener Phosphatasen (alkalische Phosphatase, FAD-Pyrophosphatase, FMN-Phosphatase) wird freies R. gebildet. In der Darmmucosa findet unter ATP-Verbrauch eine Phosphorylierung des freien Riboflavins zu FMN statt (katalysiert durch Flavokinase). Im Plasma wird R. sowohl in freier Form, als auch als FMN an Proteine (Albumin, Globulin, Fibrinogen) gebunden transportiert. Östrogen stimuliert die Bildung spezifischer Riboflavin-bindender Proteine (RfBPs), die die Plazentaschranke passieren können. Zellen nehmen R. in freier Form auf. Im Gewebe wird vorwiegend FMN (60–95 %), aber auch FAD (5–22 %) gebildet (reguliert durch das Schilddrüsenhormon T3) und häufig an Proteine gebunden (Flavoproteine). Sind diese Proteine mit Flavinen abgesättigt, findet analog zur Resorption ein Abbau zum freien R. statt. Riboflavin wird schnell über den Urin ausgeschieden. Neben R. finden sich verschiedene Metabolite, wie Lumichrom, 7- oder 8-Hydroxymethylflavin und 10-Formyl-methylflavin.
Biochemische Funktionen: Wegen ihres ausgeprägten Redoxcharakters (Abb. 2) und der Fähigkeit, direkt mit Sauerstoff reagieren zu können, nehmen die Flavoproteine eine zentrale Rolle im Stoffwechsel ein. Neben ihrer zentralen Bedeutung in der Atmungskette (Elektronentransport) spielen Flavoproteine eine wichtige Rolle beim Metabolismus von Kohlenhydraten, Fettsäuren, Aminosäuren und Pyrinen, sowie beim Wasserstofftransfer von spezifischen Dehydrogenasen zur Endoxidation in der Atmungskette. Die Flavoprotein-Monooxygenase ist in Verbindung mit dem Cytochrom-P450-Monooxygenasesystem für die oxidative Entgiftung von Xenobiotika verantwortlich (Drogen, Carcinogene, Pestizide). Flavinenzyme.
Riboflavin-Antagonisten: (Eriboflavin antagonists), als solche wirken Analoge des Isoalloxazinringes, z. B. Diethylriboflavin oder Dichlororiboflavin und der Ribityl-Seitenkette, z. B. D-Araboflavin oder D-Galactoflavin.
Mangel: Reiner Riboflavinmangel tritt fast nur unter experimentellen Bedingungen auf. Meist findet man gleichzeitig auch Mangelzustände an anderen B-Vitaminen, z. B. bei Pyridoxinmangel (Pyridoxin), sodass sich die Symptome überschneiden. (Riboflavin ist als Flavinmononucleotid zur Umwandlung von Pyridoxin in seine Coenzymform nötig.) Die klinischen Symptome sind relativ uncharakteristisch (Ariboflavinose). Suboptimale Versorgung ist meistens mit anderem Nährstoffmangel vergesellschaftet und äußert sich in Anämien, Gewichtsabnahme, Schleimhautveränderungen und Cheilosis.
Überdosierung: Diese ist über die Nahrung ausgeschlossen, selbst bei hohen Dosen wurden keine Intoxikationen beobachtet.
Therapeutische Verwendung: In erster Linie wird R. zur Substitutionstherapie bei Mangel-, und Fehlernährung, Resorptionsstörungen und Alkoholismus eingesetzt. Die therapeutische Dosis liegt bei > 10 mg / d. Glutaracidurie Typ I.
Statusbestimmung: Der Riboflavinstatus wird mit mikrobiellen und enzymatischen (Gluthationreduktase) Methoden bestimmt.
Lebensmitteltechnologische Anwendungen: R. (E 101i) und die leicht wasserlöslichen Natriumsalze seines 5’-Phosphates (E 101ii) sind gelbe, wasserlösliche Farbstoffe für Fettemulsionen, Mayonnaise, Suppen, Desserts, Kartoffeltrockenprodukte, Schmelzkäse und Süßwaren.
Riboflavin: Abb. 2. Redoxsystem der Flavine. Riboflavin
Resveratrol: Resveratrol
Riboflavin: Tab. Empfohlene Zufuhr. [Quelle: DACH, Referenzwerte für die Nährstoffzufuhr, Umschau-Braus Verlag, Frankfurt, 2000]
| |||
| Männer | Frauen | ||
| bis 4 Monate1 | 0,3 | ||
| 4–12 Monate | 0,4 | ||
| 1–4 Jahre | 0,7 | ||
| 4–7 Jahre | 0,9 | ||
| 7–10 Jahre | 1,1 | ||
| 10–13 Jahre | 1,4 | 1,2 | |
| 13–15 Jahre | 1,6 | 1,3 | |
| 15–25 Jahre | 1,5 | 1,2 | |
| 25–51 Jahre | 1,4 | 1,2 | |
| 51–65 Jahre | 1,3 | 1,2 | |
| 65 Jahre und älter | 1,2 | 1,2 | |
| Schwangere ab 4. Monat | 1,5 | ||
| Stillende | 1,6 | ||
1 = Schätzwert
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.