Lexikon der Geowissenschaften: Silicat-Kristallchemie
Silicat-Kristallchemie, die Silicate bilden zusammen mit den SiO2-Mineralen mehr als 90% der Erdkruste. Sie sind damit die häufigsten und wichtigsten Minerale der Erde und aller übrigen Himmelskörper, was vor allem damit zusammenhängt, daß Sauerstoff zu 46,6% und Silicium zu 27,7%, also insgesamt mit fast 2/3 am Aufbau der festen Erdkruste und auch der meisten festen Himmelskörper beteiligt sind. Bezogen auf das Volumen beträgt ihr Anteil damit fast 95%, während alle übrigen Elemente um oder weit unter 1% liegen (Clarke-Werte). Man kann daher die feste Erdkruste, die fast ausschließlich aus gesteinsbildenden silicatischen Mineralen besteht, auch als eine dichte Packung aus Sauerstoffionen betrachten, in der, spärlich verteilt, die übrigen Elemente sitzen. Das dritthäufigste Element ist Aluminium, das in den Silicaten das Si diadoch ersetzt. Da der Radienquotient RAl:RO von 0,43 praktisch an der Grenze von 0,414 liegt, die die Koordinationszahl KZ=4 von KZ=6 trennt, kann Al in den Silicaten sowohl in oktaedrischer als auch in tetraedrischer Koordination auftreten. Die Ladungsdifferenz zwischen Si4+ und Al3+ wird durch Substitution von Ca2+ für Na+, Fe3+ für Fe2+, Al3+ für Mg2+ usw. wieder ausgeglichen. Betrachtet man nur die Kristallstruktur, dann verhalten sich die (Si,Al)O4-Tetraeder wie SiO4-Tetraeder. Eine Klassifizierung der Silicate nach chemischen Gesichtspunkten wird durch diese Doppelrolle des Aluminiums außerordentlich erschwert. Von entscheidender Bedeutung für die Gliederung der Silicate waren daher die kristallographisch-kristallstrukturellen Ergebnisse röntgenographischer Feinstrukturuntersuchungen. Silicate, in denen Al in Sechserkoordination, also oktaedrisch von O, OH oder F umgeben ist, bezeichnet man als Aluminiumsilicate.Mineralbeispiele sind Epidot (Ca2FeAl2(OH)[Si3O12]), Beryll (Al2Be3[Si6O18]) und Spodumen (LiAl[Si2O6]). Silicate, in denen Al dagegen in Viererkoordination tetraedrisch von O umgeben ist, in denen also Al das Si substituiert und durch Substitution weiterer Ionen ein entsprechender Ladungsausgleich stattfindet, bezeichnet man als Alumosilicate,z.B. Leucit (K[AlSi2O6]) oder Anorthit (Ca[Al2Si2O8]). Schließlich unterscheidet man von diesen beiden noch eine dritte Gruppe, bei der Al sowohl tetraedrisch in 4er als auch oktaedrisch in 6er Koordination auftreten kann, und die man als Aluminium-Alumo-Silicate bezeichnet. Ein typisches Beispiel ist das Glimmermineral Muscovit (KAl2[6][(OH)2Al[4]Si3O10]).
Die große Variationsbreite der Silicate und ihrer Strukturen ist auf die mannigfaltige Art und Weise der Verknüpfung von SiO4- bzw. (Si,Al)O4-Tetraedern zurückzuführen. Eine große Vereinfachung in der Beschreibung der Strukturkombinationen ist jedoch die Tatsache, daß diese Verknüpfungen nur über die Tetraederecken stattfinden, wobei dann je ein O als Tetraederspitze beiden Anionenkomplexen gemeinsam angehört. Eine Anlagerung der Tetraeder über gemeinsame Kanten oder Flächen ist dagegen bei den Silicaten nicht möglich. Die Silicatstrukturen können aus getrennten SiO4-Tetraederinseln bestehen, die Tetraeder können sich zu endlichen Gruppen von 2, 3, 4 und 6 zusammenschließen, sie können unendliche Ketten, zweidimensionale Doppelketten, Bänder und dreidimensionale Gerüststrukturen bilden. Die hinsichtlich ihrer SiO4-Struktur einfachsten Silicate bestehen aus inselartigen SiO4-Tetraedern, die allerdings auch tetraederfremde Anionen wie O, OH und F enthalten können. Typische Vertreter der Insel-, Ortho- oder Nesosilicatesind die Minerale der Olivinmischkristallreihe ((Mg,Fe)2[SiO4]), ferner Phenakit (Be2[SiO4]), Zirkon (Zr[SiO4]), Granat, Andalusit und Topas. Außerdem gehören einige technisch wichtige Silicate hierher wie das Schlackenmineral Monticellit (CaMg[SiO4]) und das Portlandzementmineral „Alit” (Ca3[O/SiO4]). Wie eine schematische Darstellung der Kristallstruktur des Olivins ( Abb. 1) zeigt, sind die Mg- bzw. Fe-Ionen fast oktaedrisch von 6 O umgeben, wodurch die pseudohexagonale Symmetrie des an sich rhombischen Olivins verständlich wird. Bedingt durch diese dichte Sauerstoffpackung ist das hohe spezifische Gewicht, die große Härte und die hohe Lichtbrechung dieser Silicate.
Treten zwei [SiO4]4--Tetraeder zusammen, dann entstehen [Si2O7]6--Doppeltetraeder ( Abb. 2). Solche Silicatstrukturen mit endlichen Gruppenkomplexen heißen Gruppen- oder Sorosilicate.Typische Mineralvertreter sind Thortveitit (Sc2Si2O7), Hemimorphit (Zn4(OH)2/Si2O7·H2O) sowie die Minerale der Mischkristallreihe Melilith mit den Endgliedern Åkermanit (Ca2Mg[Si2O7]) und Gehlenit (Ca2Al[(Si,Al)2O7]), die als Hauptminerale von Hochofenschlacken und als Zementphasen von technischer Bedeutung sind. Durch die ringförmige Verkoppelung der [SiO4]-Tetraeder entstehen Dreier-, Vierer- und Sechserringe mit den Komplexen [Si3O9]6-, [Si4O12]8- und [Si6O18]12- ( Abb. 3). Diese Gruppe von Strukturen bezeichnet man als Ringsilicate oder auch als Cyclosilicate.Bedingt durch die Dreier- und Sechserringstrukturen – Viererringe sind unter den Mineralen sehr selten –, zeigen die Kristalle dieser Silicate häufig trigonale oder hexagonale Symmetrieelemente. Ein typischer Vertreter mit Dreierringstruktur ist das Mineral Benitoit (BaTiSi3O9). Axinit, ein Ca-Al-Borosilicat, bildet Viererringe und kristallisiert pseudokubisch. Beryll (Al2Be3[Si6O18]) baut sich aus Sechserringen auf, die längs der c-Achse übereinander angeordnet sind. Dadurch entstehen weite kanalartige Hohlräume, die gitterfremden Ionen mit großen Radien wie Kalium, Rubidium, Cäsium, Chlor, OH und Fluor den notwendigen Platz bieten. Daneben finden sich häufig auch seltene Elemente mit ungewöhnlichem Ionenradius in solchen Silicatstrukturen. Auch das Kupfersilicat Dioptas (Cu6[Si6O18]·6H2O) hat solche röhrenförmigen Hohlräume, in denen das in der Formel angegebene Wasser sitzt.
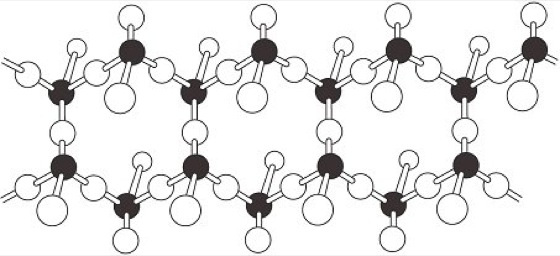
Anstelle von Ringstrukturen können die SiO4-Tetraeder sich auch zu eindimensionalen unendlichen Ketten verknüpfen. Diese kettenförmigen Strukturmerkmale drücken sich dann auch in der morphologischen Entwicklung und in den Eigenschaften der betreffenden Kristalle aus. Kettensilicate, die auch als Inosilicate bezeichnet werden (von griech. inos=Faser), zeigen einen prismatisch stengelig, nadeligen Habitus und, wie z.B. Asbestminerale, gute Spaltbarkeit und faserige Absonderung parallel zu den Kettenachsen. Die meisten Inosilicate, besonders die gesteinsbildenden Gruppen der Pyroxene und die Amphibol-Gruppe, bauen sich aus eindimensional unendlichen Ketten oder Bändern auf, deren Periodizität zwei Tetraederlängen umfaßt. Bei den Pyroxenen (CaMg[Si2O6]) liegen Kettenstrukturen vom Formeltypus [Si2O6]4- vor ( Abb. 4).Von besonderer Bedeutung für die Mineralogie ist hier die Pyroxen-Mischkristallreihe Enstatit-Bronzit-Hypersthen, von technischem Interesse für keramische Prozesse sind der monokline Klinoenstatit (Mg2[Si2O6]) und Spodumen (LiAl[Si2O6]). Bei den Amphibolen, z.B. Ca2Mg5(OH)2[Si4O1l]2, sind diese Ketten durch gemeinsame Brückensauerstoffe miteinander verknüpft, so daß sich Zweierdoppelketten oder Bandstrukturen vom Formeltyp [Si4O11]6- bilden ( Abb. 5). Die Gitterkonstante bei Einfachketten- und Doppelkettensilicaten beträgt 5,2 Å, da die Periode in der Kettenrichtung jeweils zwei SiO4-Tetraeder umfaßt. Der pseudohexagonale Wollastonit (Cyclowollastonit, CaSiO3) und das technisch wichtigeZement- und Kalksandsteinmineral Xonotlit (Ca6(OH)2[Si6O17]) bilden Dreierketten, hier beträgt die Gitterkonstante 7,3 Å. Als natürliche Minerale recht selten, um so wichtiger als technische Mineralphasen in der Zement- und Baustoffmineralogie, sind eine Reihe von Calciumhydrosilicaten wie Foshagit und Hillebrandit (Ca4[(OH)2/Si3O9]), Nekoit und Okenit (CaH2[Si2O8]·H2O) sowie Riversideit (Ca5H2[Si3O9]·2H2O) und der Tobermorit (Ca5H2[Si3O9]·4H2O), der nach der Dicke einer Elementarschicht auch als 11,3 Å-Tobermorit bezeichnet wird. Schließlich sind unter den Mineralen auch noch Silicate mit Fünferketten und einer Gitterkonstante von 12,2 Å bekannt, z.B. Rhodonit ((Mn,Ca)5[Si5O15]), und solche mit Siebenerketten, bei denen die Gitterkonstante in Kettenrichtung 17,1 Å beträgt, wie das auch in Schlacken auftretende Mineral Pyroxmangit ((Mn,Fe,Ca,Mg)7[Si7O21]).
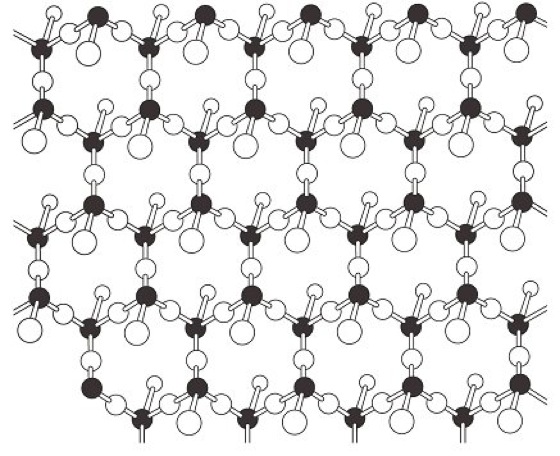
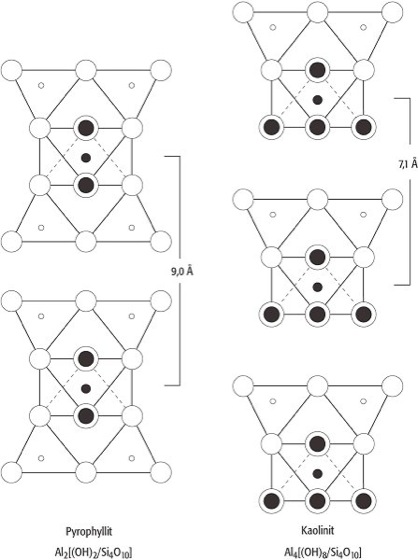
Durch die zweidimensionale Weiterverknüpfung in einer Ebene entstehen flächenhafte Netze aus Elementartetraedern, die das Grundgerüst der Schichtsilicate bilden. Anstatt über zwei Ecken an zwei Tetraedern wie bei den Inosilicaten sind die SiO4-Tetraeder bei den Phyllosilicaten(von griech. phyllos=Blatt) über drei Ecken an drei Nachbartetraeder gebunden. In diesen Schichtsilicatstrukturen bilden drei Sauerstoffionen eines Tetraeders jeweils eine Sauerstoffbrücke zu den benachbarten Tetraedern, während das vierte Sauerstoffion keine Brücke bildet, so daß die Tetraeder als eine in sich geschlossene Blattstruktur miteinander verknüpfter Sechserringe vorliegt ( Abb. 6). Auch hier kommt der schichtstrukturelle Aufbau in den Eigenschaften der betreffenden Silicate zum Ausdruck, denn sie zeichnen sich durch eine ausgezeichnete Spaltbarkeit nach den Netzebenen der Tetraederschichten aus. Solche pseudohexagonalen, zweidimensionalen Tetraederschichten liegen bei den Glimmern, bei den Chloritmineralen (Chlorit-Gruppe) und bei der Kaolinit-Serpentinitgruppe (Serpentin) vor. Seltener sind pseudotetragonale Verknüpfungen, wie sie z.B. beim Apophyllit (Ca4K[F/Si4O10]2·8H2O) vorliegen. Die SiO4-Tetraeder der pseudohexagonalen Schichten vom Formeltypus [Si2O5]2- weisen mit ihren freien Sauerstoffecken stets nach derselben Seite. An diese freien Sauerstoffe können sich Kationen wie Mg2+ oder Al3+ binden, die dann wieder von 6 O- oder OH-Gruppen umgeben sind. Eine solche Zweischichtstrukturzeigen viele Tonminerale, wie z.B. Kaolinit (Al2[(OH)4Si2O5], Abb. 7) sowie die Minerale Chrysotil und Antigorit (Mg3[(OH)4Si2O5]). Während der Kaolinit, wie sich elektronenmikroskopisch nachweisen läßt, Kristalle im Habitus pseudohexagonaler tafeliger Plättchen bildet, handelt es sich bei den Antigoritformen um wellblechartige, beim Chrysotil um röllchenförmige Kristallaggregate, was man darauf zurückführt, daß die Mg(OH)2- und die SiO2-Schichten nicht exakt aufeinander passen.
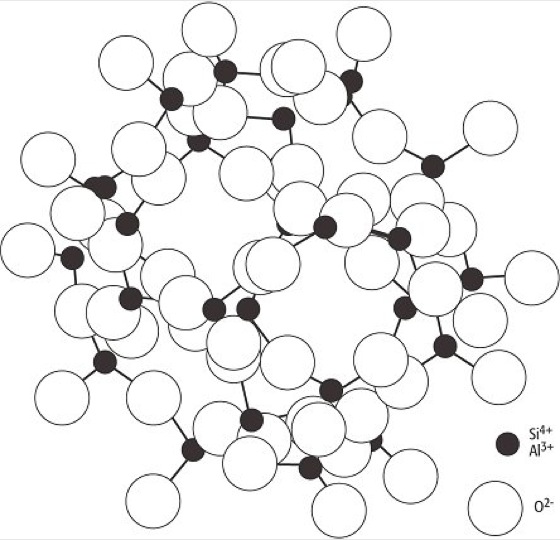
Jeweils zwei Si2O5-Netze können auch über die Kationen, z.B. über Mg2+ oder Al3+, miteinander verknüpft werden, so daß sich die freien Sauerstoffecken der beiden Si2O5-Netze spiegelbildlich zueinander verhalten. Einen derartigen Aufbau der Phyllosilicate, der z.B. beim Pyrophyllit (Al2[(OH)2Si4O10]) vorliegt, bezeichnet man als Dreischichtstruktur (Dreischichtminerale). Bei der Gruppe der Glimmer wird innerhalb einer Pyrophyllitschicht 1/4 der Si4+-Ionen durch Al3+-Ionen in der Viererkoordination ersetzt und das dadurch hervorgerufene Ladungsdefizit im Gitter durch Alkaliionen ausgeglichen. Diese Alkaliionen ( Abb. 8) zeigt die Struktur der Glimmer, am Beispiel von Muscovit liegen sie dabei in Zwölferkoordination zwischen den Schichtpaketen. Die Glimmer bestehen daher aus (Si,Al)2O5-Schichten, die den benachbarten Schichten jeweils die Tetraederspitzen zukehren. In der Ebene der Tetraederspitzen sind alle freien Plätze von OH-Ionen besetzt. Die Verknüpfung der Schichten auf der Seite der Tetraederspitzen erfolgt über Al, bei manchen Glimmern auch über Mg, wobei Al oktaedrisch von vier O- und zwei OH-Ionen koordiniert ist. Zwischen den Schichten liegen die großen Alkaliionen, bei Muscovit Kalium, bei anderen Glimmern Natrium oder Calcium, alle jeweils in Zwölferkoordination. Die Alkaliionen können auch durch OH- ersetzt werden; in der Natur entstehen so die Hydroglimmer, aus denen schließlich unter entsprechenden genetischen Bedingungen Montmorillonitminerale (Montmorillonit) entstehen. Alle Phyllosilicate zeigen die typischen Schichtgittereigenschaften, d.h. eine vollkommene Spaltbarkeit, einen pseudotetragonalen bzw. pseudohexagonalen Habitus und einen fast immer optisch negativen Charakter der Doppelbrechung. Neben den Tonmineralen und den Glimmern bilden auch die Minerale Apophyllit, Pyrophyllit und Talk silicatische Schichtgitter. Auch die Serpentinminerale und Chrysotil zeigen in ihrem Gitterabbau eine kaolinartige Schichtsilicatstruktur. Dabei sind die Schichtpakete beim Antigorit (Blätterserpentin), wie bereits angedeutet, in wellblechartiger Form deformiert, während sie beim Chrysotil (Faserserpentin) zu Röhrchen gerollt vorliegen. Elektronenmikroskopische Untersuchungen zeigen, daß auch spiralige Einrollungen möglich sind und daß die Füllung der Röhrchen aus amorphem Material bestehen kann. Die technischen Eigenschaften von Serpentinasbest (Asbest) wie Faserlänge und Spinnfähigkeit sind auf diese strukturellen Eigenarten zurückzuführen. Durch allseitige Verknüpfung der SiO4-Tetraeder ergibt sich schließlich ein dreidimensionaler Gerüstbau, wie er auch bei den SiO2-Modifikationen vorliegt. Während dort jedoch die Tetraedergerüste valenzmäßig vollständig abgesättigt sind, wird bei den Silicaten ein Teil der Si4+-Ionen durch Al3+-lonen ersetzt und die negativen Restladungen durch Kationen wie K+, Na+ und Ca2+ ausgeglichen. Mit ganz wenigen Ausnahmen bilden die Gerüst- oder Tektosilicate,wie sie auch genannt werden, Alkali- und Erdalkalialumosilicate. Die Strukturgerüste der Tektosilicate sind sehr locker und weitmaschig gebaut, wodurch kanalartige Hohlräume auftreten ( Abb. 9). Damit ist die Möglichkeit von Einlagerungsstrukturen gegeben, d.h. es können ohne wesentliche Veränderung der Struktur zusätzliche Ionen oder Moleküle in das Gitter eingebaut werden, was besonders charakteristisch bei den Zeolithen der Fall ist, die H2O in die Gitterhohlräume einlagern. Eine weitere Folge des lockeren Gitterbaues der Tektosilicate ist ihr geringes spezifisches Gewicht, die für Silicate relativ geringe Härte nach Mohs (Mohssche Härteskala) von 4-6 und eine niedrige Lichtbrechung. [GST]
Silicat-Kristallchemie 1: schematische Darstellung der Olivinstruktur. Silicat-Kristallchemie 1:

Silicat-Kristallchemie 2: Gruppensilicat-Komplex. Silicat-Kristallchemie 2:

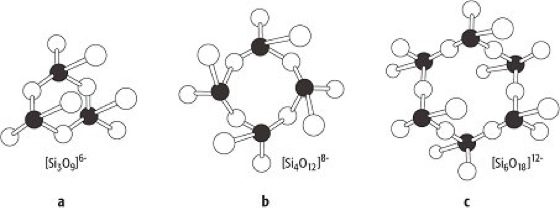
Silicat-Kristallchemie 3: a)–c) Ringsilicat-Komplexe. Silicat-Kristallchemie 3:
Silicat-Kristallchemie 4: Kettensilicat. Silicat-Kristallchemie 4:

Silicat-Kristallchemie 5: Bandsilicate. Silicat-Kristallchemie 5:
Silicat-Kristallchemie 6: Schichtsilicate. Silicat-Kristallchemie 6:
Silicat-Kristallchemie 7: Prinzip der Zwei- und Dreischicht-Strukturen. Silicat-Kristallchemie 7:
Silicat-Kristallchemie 8: Muscovit-Struktur. Silicat-Kristallchemie 8:
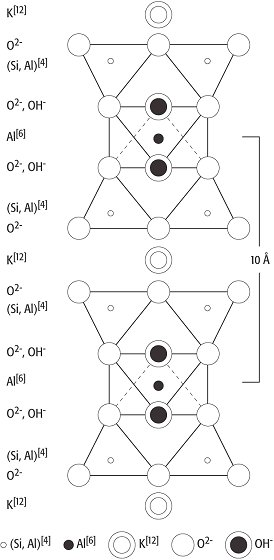
Silicat-Kristallchemie 9: Gerüstsilicat-Struktur der Zeolithe. Silicat-Kristallchemie 9:
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.