Lexikon der Neurowissenschaft: Schlaf
Essay
Dieter Riemann
Schlaf
Historisches
In der griechischen Mythologie war Hypnos, der Gott des Schlafs, dafür verantwortlich, sowohl den Menschen als auch den Tieren den Schlaf (E sleep) zu bringen. Der Sage nach lebte er in einem düsteren Tal, das vom Fluß des Vergessens bewässert wurde, und am Eingang seiner Behausung wuchsen Kräuter, denen man schlafinduzierende Wirkung zuschrieb. Diese mythologische Sichtweise verdeutlicht die enge Verknüpfung, die zwischen Schlaf und Tod hergestellt wurde, da Hypnos der Bruder von Thanatos, dem Gott des Todes, war. Diese Anschauung, den Schlaf als passiven, inaktiven Zustand zu sehen, bestimmte bis Mitte des 19. Jh. auch die wissenschaftliche Auseinandersetzung mit dem Thema.
Erste experimentelle Zugangsweisen zum Forschungsgegenstand "Schlaf" verfolgte Kohlschütter mit Weckschwellenversuchen. Erst durch die Entdeckung und Beschreibung des menschlichen Elektroencephalogramms (EEG) durch den Jenaer Psychiater Hans Berger in den 1920er Jahren wurde es möglich, die hirnelektrische Aktivität sowohl im Wachen als auch während des Schlafs zu messen ( siehe Abb. 1 ). Die intensivere naturwissenschaftliche Auseinandersetzung mit dem Phänomen "Schlaf" begann erst im Jahre 1953, als Aserinsky und Kleitmann ihre bahnbrechende Entdeckung des REM-Schlafs (rapid eye movement-Schlaf = Schlaf mit schnellen Augenbewegungen) beschrieben.
Physiologie des Schlafs
Initiiert durch die Entdeckung des REM-Schlafs wurde 1968 von den amerikanischen Schlafforschern Rechtschaffen und Kales eine immer noch gültige Klassifikation der verschiedenen Schlafstadien vorgelegt. Danach wird der Schlaf in die sogenannten non-REM-Schlaf-Stadien I-IV (NREM-Schlaf) und den REM-Schlaf differenziert. Die einzelnen Schlafstadien werden dabei auf Verhaltens- und elektrophysiologischer Ebene definiert.
Stadium I: Übergang zwischen Wachen und Schlafen. Die im entspannten Wachzustand vorherrschenden Alpha-Wellen gehen in Theta-Wellen über, die Muskelspannung (mittels Elektromyographie [EMG] zu messen) ist noch relativ hoch. Die Augen rollen langsam, was mit dem Elektrookulogramm (EOG) erfaßbar ist. Auf kognitiver Ebene sind bei Weckungen aus diesem Zustand langsame, statische Traumbilder (hypnagoge Halluzinationen) erinnerbar.
Stadium II: der eigentliche Einschlafzeitpunkt. Im Hirnstrombild sind typische Graphoelemente wie etwa Schlafspindeln oder K-Komplexe nachweisbar. Die Muskelspannung sinkt gegenüber dem Stadium I ab, Augenbewegungen treten nicht auf. Bei Weckungen aus diesem Zustand sind bei Probanden kognitive Inhalte abrufbar, die gedanklichen Inhalten des Wach-Erlebens ähneln.
Stadien III und IV: werden als Tiefschlaf bzw. slow wave sleep zusammengefaßt. Das EEG wird nun durch langsamwellige Delta-Wellen in einem Frequenzbereich von 0,5-2 Hz dominiert; die Muskelspannung ist weiter abgesunken, Augenbewegungen treten nicht auf. Kognitive Inhalte sind bei Weckungen aus diesem Zustand selten abrufbar.
REM-Schlaf: Das EEG des REM-Schlafs ähnelt sehr dem Stadium I, d.h., es zeigt sich ein niederfrequentes Hirnstrombild mit Alpha-Einstreuungen und sogenannten Sägezahnwellen. Die Muskelspannung erreicht das niedrigste Niveau während der Ableitung, das EOG zeigt schnelle, konjugierte Augenbewegungen. Bei Weckungen aus dem REM-Schlaf werden in bis zu 90% aller Fälle von gesunden Probanden typische Traumberichte visuell-halluzinatorischen Charakters wiedergegeben (Träume). Der REM-Schlaf wird zudem von einer erhöhten Variabilität der Herz- und Atemfrequenz, kurzen Zuckungen der Muskulatur sowie Peniserektionen beim Mann und einer Erhöhung der vaginalen Durchblutung bei der Frau begleitet ( siehe Abb. 1 ).
Ontogenese des Schlafs
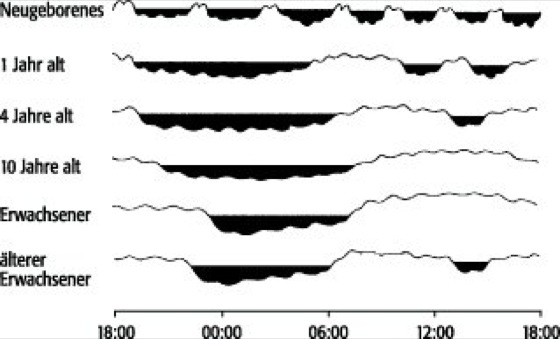
Das typischerweise bei den meisten Erwachsenen im westlichen Kulturkreis vorgefundene monophasische Schlafmuster mit einer kontinuierlichen 16-17stündigen Wachperiode und einer etwa 7-8stündigen Ruhezeit in der Nacht herrscht keineswegs über die ganze Lebensspanne vor ( siehe Abb. 2 ). Während beim Neugeborenen ein polyphasischer Schlafrhythmus mit 5-6 Schlafphasen vorliegt, die etwa alle 4 Stunden durch Wachperioden unterbrochen werden, hat sich beim 1jährigen Kleinkind der Schlaf bereits in der Nacht konsolidiert; tagsüber treten noch 2 kurze Schlafperioden auf. Ab ca. dem 4. Lebensjahr nimmt die während der Nacht geschlafene Zeit weiter zu, und tagsüber findet sich noch eine kurze Schlafperiode. Meist entfällt spätestens ab dem 6. Lebensjahr der Mittagsschlaf. Mit zunehmendem Erwachsenenalter nimmt die Schlafdauer weiter ab und pendelt sich ca. ab dem 30. Lebensjahr bei 7-8 Stunden ein. Im höheren Erwachsenenalter, vor allem bei nicht mehr im Arbeitsleben stehenden Menschen, tritt häufig wieder ein biphasisches Schlafmuster mit einem "Nickerchen" nach dem Mittagessen auf. Während die Gesamtschlafdauer beim Neugeborenen bei ca. 16-20 Stunden liegt, sinkt sie beim gesunden Erwachsenen auf ca. 7-8 Stunden ab. Mit dem Lebensalter verändert sich nicht nur die Struktur der Schlaf-Wach-Rhythmik, sondern auch die interne Architektur des Schlafs. Während zu Beginn des Lebens der Schlaf bis zu 50% von REM-Schlaf dominiert wird, pendelt sich der REM-Schlaf spätestens ab der Pubertät bei ca. 20% der Gesamtschlafzeit ein, um mit zunehmendem Alter nur noch geringfügig abzusinken ( siehe Abb. 1 ). Die NREM-Schlaf-Anteile zeigen weniger Variabilität über die Lebensspanne. Dies gilt jedoch nicht für die Tiefschlafanteile, die Stadien III und IV, die mit zunehmendem Alter deutlich reduziert werden.
Phylogenese des Schlafs
Studien an vielen Tierarten wiesen nach, daß keineswegs alle Spezies sowohl nicht-REM-(NREM-) als auch REM-Schlaf zugleich aufweisen. Die entwicklungsgeschichtlich älteren, nicht-lebendgebärenden Säugetiere weisen nur NREM-Schlaf auf, während z.B. bei Vögeln ausschließlich im Kükenalter REM-Schlaf auftritt, später nur noch NREM-Schlaf. Sowohl Beutel- als auch Plazentatiere zeigen das für den Menschen typische alternierende Muster von NREM- und REM-Schlaf. Es gibt Spekulationen darüber, daß sowohl das Auftreten als auch das Ausmaß des prozentualen REM-Schlaf-Anteils bei Säugetieren mit der kognitiven Entwicklung und dem Gehirngewicht korrelieren. Untersuchungen zur Phylogenese des Schlafs sind von besonderem Interesse für die Fragen nach der Funktion des Schlafs. So wurde gezeigt, daß Körpergewicht und Schlaflänge einer Spezies zusammenhängen. Tiere mit hohem metabolischem Umsatz, wie z.B. kleine Nagetiere, zeigen längere Schlafepisoden, während Tiere mit niedriger metabolischer Umsatzrate, z.B. Elefanten, im Vergleich dazu kurze Schlafzeiten und weniger Tiefschlaf aufweisen. Für Tiere mit hohem metabolischem Umsatz dürften die Vorteile des Schlafs und insbesondere des Tiefschlafs in seiner energiesparenden Funktion liegen. Der Schlaf und die dadurch erzwungene Ruhe erlaubt es, Energie zu sparen und zu konservieren. Das zyklische Auftreten von REM-Schlaf könnte dazu dienen, den schlafenden Organismus in rhythmischen Abständen zu aktivieren, um ein zu tiefes Absinken neuronaler und zentralnervöser Funktionen zu verhindern. Die Entwicklung des REM-Schlafs könnte sich damit besonders günstig auf Hirnreifung und kognitive Entwicklung einer Spezies ausgewirkt haben.
Schlaf-Wach-Regulation
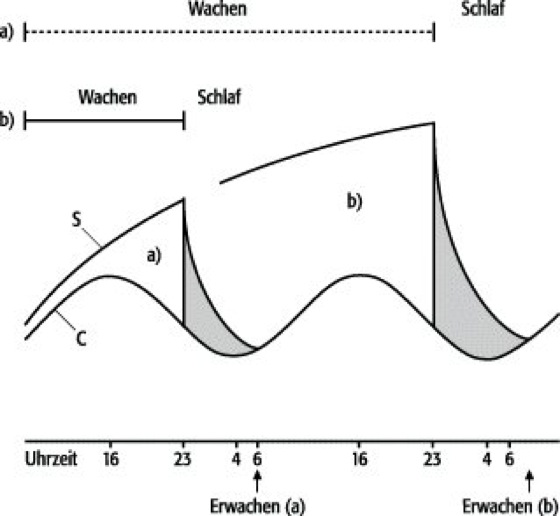
Bereits zu Beginn des 20. Jahrhunderts wurde ein sog. Hypnotoxin als Schlafursache postuliert (Hypnotoxin-Hypothese). Man nahm an, daß sich während der Wachzeit eine Substanz im Organismus anreichere, die ab einem gewissen Niveau Müdigkeit und letztendlich Schlaf herbeiführe. Seit Mitte des 20. Jh. entwickelte Theorien von Neurophysiologen konzentrierten sich auf den Hirnstamm als Sitz der Schlaf-Wach-Regulation. Wie Tierexperimente zeigten, gibt es ein aufsteigendes Aktivierungssystem der Formatio reticularis des Hirnstamms (das aufsteigende reticuläre aktivierende System, Abk. ARAS), das primär für die Aufrechterhaltung des Wachzustands verantwortlich ist ("Wachzentrum"). Ursprünglich wurde Schlaf als passiver Zustand angesehen, der als Folge eines Mangelzustands an genügend starken stimulierenden Weckreizen auftritt. Schlaf läßt sich aber auch durch eine aktive Hemmung der Systeme, die den Wachzustand aufrechterhalten, herbeiführen. Nicht nur neuronale Zentren im Hirnstamm, sondern auch höhere Hirnareale im Thalamus und Hypothalamus sowie in der Großhirnrinde steuern das komplexe Wechselspiel der Schlaf-Wach-Regulation (Träume, Zusatzinfo 1). Der französische Neurobiologe Jouvet formulierte eine Neurotransmitter-Theorie des Schlafs. Serotonin wurde mit dem NREM-Schlaf in Verbindung gebracht, während Noradrenalin mit dem REM-Schlaf assoziiert wurde. Die amerikanischen Neurophysiologen Hobson und McCarley stellten das zur Zeit unumstrittenste Modell der Regulation von NREM- und REM-Schlaf auf. Basierend auf experimentellen Untersuchungen an Katzen konnte gezeigt werden, daß die Steuerungszentren von NREM- und REM-Schlaf vornehmlich im Hirnstamm lokalisiert sind. Während aminerge Neuronengruppen in den dorsalen Raphekernen und dem Locus coeruleus während des NREM-Schlafs aktiv sind, findet sich während des REM-Schlafs ein Überwiegen cholinerger neuronaler Aktivität besonders im gigantozellulären Feld der Brückenhaube. Der zyklische Ablauf von NREM- und REM-Phasen wird durch die reziproke Interaktion aminerger und cholinerger neuronaler Aktivität dominiert. Über die interne Regulation von NREM- und REM-Schlaf hinaus formulierte der schweizerische Pharmakologe Borbély das Zwei-Prozeß-Modell des Schlafs ( siehe Abb. 3 ) als Versuch, den Ablauf der Schlaf-Wach-Rhythmik genauer zu erklären. Er integrierte dabei viele der bis zum damaligen Zeitpunkt vorliegenden Erkenntnisse aus der Grundlagenforschung in seine Theorie, insbesondere Daten zur Frequenzanalyse des Schlaf-EEGs und Experimente zum Schlafentzug.
Funktion des Schlafs
Eine befriedigende, naturwissenschaftlichen Kriterien genügende Antwort auf die Frage nach der Funktion des Schlafs ist bis heute nicht gelungen. Schlaf ist ein phylogenetisches Verhaltensrelikt: Diese Annahme stützt sich auf Schlafentzugsexperimente an Gesunden. Bei Schlafentzugsexperimenten über Zeiträume von 5 bis 10 Tagen konnten keine organischen oder psychischen Schäden, sondern "nur" extreme Müdigkeit provoziert werden, die dann zu gehäuften Mikroschlafepisoden und schließlich zum Schlaf führt. Inzwischen konnte eindeutig nachgewiesen werden, daß Schlafentzug im Tierexperiment auch unter soweit streßfreien Bedingungen zu einem Entgleisen des Metabolismus und letztendlich zum Tod führt. Auf jeden Fall gesichert für den Schlaf ist eine energiesparende und energiekonservierende Funktion im Sinne metabolischer Erholung.
Da REM-Schlaf beim Neugeborenen fast 50% der Schlafzeit dominiert, wurde dies als Beleg dafür herangezogen, daß Schlaf und insbesondere REM-Schlaf der Ausbildung neuronaler Regelkreise und damit der Hirnreifung dient. Für den REM-Schlaf wird zudem angenommen, daß er auch beim Erwachsenen der Verarbeitung von tagsüber aufgenommenen Informationen dient ( siehe Zusatzinfo ).
Da eine exakte Erklärung zur Funktion des Schlafs bisher noch nicht gelang, muß man sich vorerst mit der Alltagsweisheit begnügen: Schlaf ist das beste Mittel gegen Müdigkeit. Epiphyse, Hypnotika, Melatonin, Winterschlaf.
Lit.: Berger, M., Riemann, D., Steiger, A. (Hrsg.): Handbuch des normalen und gestörten Schlafs. Heidelberg, New York, 1992. Deutsche Gesellschaft für Schlafforschung und Schlafmedizin und H. Schulz (Hrsg.): Kompendium Schlafmedizin für Ausbildung, Klinik und Praxis. Landsberg/Lech, 1997. Hobson, J.A.: Sleep. New York, 1989.
Neuroendokrinologie des Schlafes: Schlaf wird auf physiologischer Ebene primär aufgrund zentralnervöser Erregungsprozesse identifiziert, die sich in unterschiedlicher rhythmischer Aktivität im Elektroencephalogramm (EEG) niederschlagen. Allein anhand dieser Erregungsprozesse lassen sich auch die beiden wichtigsten Schlafstadien unterscheiden, der REM–Schlaf und der Delta-Schlaf (slow wave sleep), die "intensivste" Form des non-REM-Schlafs (NREM-Schlaf). Schlaf und Schlafstadien sind eng an unterschiedliche Prozesse neuroendokriner Regulation gekoppelt, die in essentieller Weise die Schlafarchitektur mitbestimmen. Zu Beginn des nächtlichen Schlafs kommt es während der ersten ausgeprägten Delta-Schlafperioden zu einer starken Aktivierung der somatotropen Achse, so daß der Wachstumshormon-Spiegel (Somatotropin, GH) im Blut zu dieser Zeit ein Tagesmaximum erreicht. Gleichzeitig wird die sekretorische Aktivität im Hypothalamus-Hypophysen-Nebennierenrinden-System (Streß) gehemmt, so daß die Cortisol- und Adrenocorticotropin- (ACTH, adrenocorticotropes Hormon) Spiegel im Blut zu dieser Zeit ein Minimum erreichen. Cortisol- und ACTH-Spiegel steigen in der zweiten Schlafhälfte deutlich an, um ein Tagesmaximum ungefähr zum Zeitpunkt des morgendlichen Erwachens zu erreichen. Auf die Freisetzung von Thyreotropin (TSH) übt der Schlaf einen unterdrückenden Einfluß aus, der dem in den späteren Abendstunden erreichten circadianen Maximum der TSH-Freisetzung entgegenwirkt. NREM- und insbesondere Delta-Schlafphasen gehen mit einer insgesamt gesteigerten sekretorischen Aktivität der Adenohypophyse einher, insbesondere in bezug auf die Freisetzung von GH, Prolactin und luteinisierendem Hormon (LH). Umgekehrt unterliegt die hypophysäre sekretorische Aktivität im REM-Schlaf einer weitgehenden Hemmung. Die Freisetzung des Melatonins, ein Neurohormon der Epiphyse, ist primär an den Hell-Dunkel-Wechsel gekoppelt. Es wird entsprechend in der Schlafphase verstärkt freigesetzt. Die enge Kopplung von Schlaf und neuroendokriner Regulation zeigt sich auch darin, daß Störungen des Schlafs in der Regel mit deutlichen Veränderungen der neuroendokrinen Schlafstruktur verbunden sind. So ist z.B. die Verschlechterung des Schlafs im Alter nicht nur durch eine Reduktion des Delta-Schlafs charakterisiert, sondern gleichzeitig ist auch die GH-Freisetzung im frühen Schlaf deutlich vermindert und die Cortisolfreisetzung zu dieser Zeit erhöht ( siehe Zusatzinfo 1 ). Die Schlaf-assoziierte Regulation der meisten neuroendokrinen Systeme interagiert mit circadianen Rhythmen und Oszillatoren. Allerdings scheint für einige Systeme, wie z.B. das somatotrope System, die Schlaf-abhängige Regulation deutlich zu dominieren. Teils direkt, teils auch über Feedbacksignale ihrer peripheren Drüsen üben viele der neuroendokrinen Achsen einen Schlaf-steuernden bzw. –modulierenden Einfluß aus. Auch in diesem Zusammenhang scheint der somatotropen Achse eine besondere Rolle zuzufallen, insofern tierexperimentelle Arbeiten zeigen, daß Gaben von Somatotropin-Releasing-Hormon (Somatoliberin) Schlaf und Delta-Schlaf induzieren können. Die im Schlaf generierten Muster endokriner Aktivität sind Schlaf-spezifisch und treten in dieser Form während der Wachphase nicht auf. Ihre funktionale Bedeutung ist wenig erforscht. Vermutet wird, daß auf metabolischer Ebene anabole Prozesse des Zellaufbaus unterstützt werden. Zentralnervös könnten diese Muster Prozesse synaptischer Plastizität und der Langzeitgedächtnisbildung unterstützen ( siehe Zusatzinfo 2 ). slow wave sleep.
J.B.

Schlaf
Abb. 1:
A EEG verschiedener Schlafstadien:
Während des ruhigen entspannten Wachseins herrscht ein Alpha-Rhythmus vor (a), der beim Einschlafen (b) von flachen Theta-Wellen verdrängt wird. Beim Leicht-Schlaf (c) nimmt die Frequenz weiter ab, bis schließlich Delta-Wellen vorherrschen, in die Gruppen von Schlafspindeln eingeschoben sind. Während des mitteltiefen Schlafs (d) sind zwischen die Delta-Wellen K-Komplexe eingeschoben, das Tiefschlafstadium (e) ist durch große, langsame Delta-Wellen charakterisiert.
B Darstellung eines Schlaftiefenverlaufs innerhalb einer Nacht: Die einzelnen Stadien werden mehrfach durchlaufen, während die REM-Phasen zum Morgen hin immer länger werden. Die Tiefschlafphasen werden dagegen immer kürzer und zum Morgen hin nicht mehr erreicht.
C Dauer des täglichen Schlafs und zeitliche Verteilung des REM- und NREM-Schlafs. Im Laufe des Lebens nimmt nicht nur die Schlafdauer ab, sondern auch der Anteil des REM-Schlafs am Gesamt-Schlaf innerhalb einer Nacht. Charakteristisch ist die starke Abnahme des REM-Schlaf-Anteils nach dem Kleinkindalter.
Schlaf
Abb. 2: Entwicklung des Schlaf-Wach-Rhythmus vom Säuglings- bis ins hohe Erwachsenenalter (schwarz = Schlaf)
Schlaf
Abb. 3: Zwei-Prozeß-Modell der Schlaf-Wach-Regulation nach Borbély (1982)
Wie spektralanalytische Untersuchungen des Schlaf-EEGs gezeigt haben, kommt es nach Schlafentzug zu einer Zunahme der langsamwelligen Delta-Aktivität. Dieser "Rebound" an Delta-Aktivität bzw. Tiefschlaf läßt sich durch Frequenzanalysen besser darstellen als durch die übliche visuelle Schlafstadien-Klassifikation. Nach Borbély besteht zwischen Delta-Wellen-Aktivität und vorhergegangener Wachzeit ein linearer Zusammenhang; d.h. je länger die dem Schlaf vorhergehende Wachzeit ist, desto mehr Delta-Wellen treten auf. Die Delta-Wellen im Schlaf werden jedoch nicht linear über den ganzen Verlauf der Nacht produziert, sondern nehmen exponentiell mit der Schlafdauer ab. Borbély schlug vor, diesen von der Wachzeit abhängigen homöostatischen Prozeß als S(-Schlaf) zu bezeichnen. Der zweite wichtige Prozeß in diesem Modell ist Prozeß C. Die Einführung dieses Prozesses trägt der Tatsache Rechnung, daß Schlafen und Wachen in eine Vielzahl anderer biologischer Rhythmen eingebettet sind. Prozeß C verläuft parallel zur Körpertemperatur. Die Interaktion zwischen den Prozessen C und S bestimmt das Schlaf-Wach-Verhalten. Je größer die Schere zwischen den beiden Kurven, desto höher die Schlafbereitschaft. Laufen die beiden Kurven zusammen, d.h. wurde Prozeß S im Schlaf abgebaut und steigt C an, kommt es zum Erwachen. Prozeß S steigt bei Schlafentzug stärker an (b). Der exponentielle Abfall von S im Schlaf bewirkt jedoch, daß die Schlafzeit nach Schlafentzug nicht linear zunimmt.
Schlaf
Schlafentzug hat auf viele Tiere und den Menschen verheerende Folgen für das Gedächtnis. Besonders Fertigkeiten, die kurz vor dem Einschlafen erlernt wurden, sind davon betroffen. Am stärksten wirkt sich eine Unterbrechung in der REM-Phase auf das Gedächtnis des Menschen aus. Es konnte gezeigt werden, daß im Schlaf neuronale Erregungsmuster wiederholt werden, die kurz zuvor im Gehirn z.B. beim Erwerb neuer Fähigkeiten oder bei der Aufnahme neuer Eindrücke entstanden. Diese Wiederholungen von neuronalen Erregungsmustern sorgen vermutlich dafür, daß neue Informationen dauerhafter gespeichert werden.
Schlaf
1 Abnahme der Schlafqualität mit dem Alter: Im Laufe des Lebens ändern sich die Schlafgewohnheiten abhängig vom Alter. Am offensichtlichsten ist dies bei Babys und Kleinkindern, deren zunächst sehr lange Schlafphasen in den ersten Lebensjahren deutlich reduziert werden, jedoch auch bei Erwachsenen ist der Schlafrhythmus einem steten Wandel unterzogen. So ändert sich etwa zwischen dem 20. und 45. Lebensjahr die Schlafqualität deutlich: bei gleichbleibender Schlaflänge nehmen die Tiefschlafphasen stark ab, der "leichte" Schlaf dafür zu. Da der Hypothalamus während des Tiefschlafs das Hormon Somatotropin abgibt, verringert sich auch dessen Konzentration im Körper. Möglicherweise ist dies ein Grund für den häufig in dieser Lebensphase vorkommenden Verlust an Muskelmasse und verstärkter Tendenz zur Fettleibigkeit. Nach dem 50. Lebensjahr nimmt dann in einer zweiten Phase der Schlafverschlechterung auch die Gesamtschlafmenge ab, wobei auch die REM-Schlafphasen deutlich reduziert werden, teilweise um 50% gegenüber dem Schlaf von Jugendlichen. Dieser Verlust an REM-Schlaf scheint auch mit einem abendlich erhöhten Spiegel von Cortisol einherzugehen, was wiederum die Wahrscheinlichkeit erhöhen könnte, im Alter an Diabetes mellitus zu erkranken und an Gedächtnisverlust zu leiden.
Schlaf
2 Schlaf und Lernen: In Schlafentzugsexperimenten konnte nachgewiesen werden, daß Schlaf essentiell für die Konsolidierung von neu Gelerntem ist. Dabei scheint vor allem die frühe Phase des slow wave sleep von Bedeutung zu sein: Fehlt diese, so kann das am Tag Gelernte auch in einem späteren REM-Schlaf nicht mehr im Gedächtnis verankert werden. Die genauen Vorgänge dieser Konsolidierung sind jedoch noch nicht bekannt.
Schreiben Sie uns!