Lexikon der Neurowissenschaft: Sehfarbstoffe
Sehfarbstoffe, Sehpigmente, Photopigmente, Evisual pigments, in den Membranen von Photorezeptoren eingelagerte Farbstoffe. Sie finden sich sowohl in den hochorganisierten Augen höherer Lebewesen als auch in einzelnen lichtempfindlichen Zellen niederer Organismen, bei denen rein phototaktische Reaktionen hervorgerufen werden. Es ist eine Vielzahl von Sehfarbstoffen charakterisiert worden, deren Absorptionsmaxima die Lichtabsorption im gesamten sichtbaren Spektralbereich vom nahen Ultraviolett (z.B. bei Bienen nachgewiesen) bis fast in den Bereich des Infrarots ermöglichen. Die Sehfarbstoffe stellen strukturell sehr hydrophobe Membranproteine dar (Opsine), die einen Retinsäure-Abkömmling als Chromophor gebunden haben (Retinal). Sie fungieren als sehr empfindliche Lichtdetektoren. Um auch bei geringsten Lichtintensitäten eine möglichst hohe Wahrscheinlichkeit für die Absorption eines Photons zu erhalten, sind die Sehfarbstoffe in hohen Konzentrationen in äußeren Segmenten der hochspezialisierten Sehzellen angeordnet. Außerdem wird die Antwort auf die Absorption eines Photons in der Sehzelle extrem verstärkt (Sehkaskade). Für den am besten untersuchten Vertreter der Sehfarbstoffe, das Rhodopsin (Sehpurpur) aus den Stäbchen der Säugetiere, wurde abgeleitet, daß bereits die Absorption eines einzigen Photons entsprechender Wellenlänge (Absorptionsmaximum des Rhodopsins von Primaten: ca. 500 nm) ausreicht, um nach hoher Verstärkung eine neuronale Antwort der Sehzelle hervorzurufen. Beim Menschen führt dies jedoch nicht zu einer Wahrnehmung, denn durch ein einziges Photon wird die Sehschwelle nicht erreicht. Die direkte Auswirkung eines durch die Sehfarbstoffe absorbierten Lichtquants besteht in der Photoisomerisierung des Chromophors. Diese wiederum löst im Opsin konformelle Änderungen aus ( siehe Abb. ), welche zur Aktivierung einer hochverstärkten Enzymkaskade führen, durch die schließlich eine Änderung des Membranpotentials der gesamten Sehzelle erreicht wird. – Bei allen Wirbeltieren und einer großen Zahl von Wirbellosen bildet Retinal (Vitamin-A1-Aldehyd) in seiner 11-cis-Form den visuellen Chromophor. Das Retinal ist bei einigen Wirbeltieren-Gruppen (die meisten Süßwasserfische und einige Amphibienarten), zum Teil nur während bestimmter Erscheinungsformen (Larval-/Adultstadium), durch die A2-Form (3-Dehydroretinal) ersetzt; der Sehfarbstoff wird dann Porphyropsin genannt. Dieser Austausch hat aufgrund der hohen konformellen Ähnlichkeit beider Chromophore für die Proteinkomponente keinerlei Konsequenzen, führt aber zu einem etwas ins Rot verschobenen Absorptionsmaximum des Sehpigments und wird als Anpassung an die im Süßwasser vorherrschende veränderte Spektralverteilung des einfallenden Lichts interpretiert. Neben diesen beiden einander strukturell sehr ähnlichen visuellen Chromophoren wurde bei vielen Insektenarten 3-Hydroxyretinal, z.T. zusammen mit Retinal, z.T. als alleiniger Chromophor, identifiziert; der entsprechende Sehfarbstoff heißt Xanthopsin. Bei einigen 3-Hydroxyretinal-Insektenarten (höhere Dipteren) konnte man neben dem visuellen Chromophor ein zweites Farbstoffmolekül, den entsprechenden Alkohol (3-Hydroxyretinol), nachweisen, der ebenfalls im Protein gebunden ist und als sensibilisierendes Pigment (E sensitizing pigment) für Ultraviolett dient. Diese Konstruktion hat für die Tiere den Vorteil, den Spektralbereich des wahrnehmbaren Lichts ins UV zu erweitern, ohne ein vollständig neues Pigment entwickeln zu müssen. Das in bisher einer Tintenfischart als funktioneller visueller Chromophor nachgewiesene 4-Hydroxyretinal wird offensichtlich aus der Chromophorbiosynthese ausgeschleust, da es ein Zwischenprodukt bei der biologischen Darstellung des 3-Dehydroretinals aus der A1-Form bildet und da beide Retinale (A1 und A2) in den Augen dieser Tintenfische (Watasenia scintillans) ebenfalls als Chromophore dienen. Die breite Absorptionsvarianz der Sehfarbstoffe beruht jedoch, mit der Ausnahme des A1/A2-Austauschs, nicht auf der Verwendung unterschiedlicher Chromophore (man findet in den Sehfarbstoffen höherer Wirbeltiere ausschließlich das 11-cis-Retinal), sondern ist auf die den Chromophor im Protein direkt umgebenden Aminosäuren zurückzuführen. Diese beeinflussen durch ihre Polarität oder elektronischen Eigenschaften das Doppelbindungssystems des Retinals und bestimmen somit die Wellenlänge der maximalen Absorption. Untersuchungen zeigen, daß die An- oder Abwesenheit bereits weniger Aminosäurereste in Nachbarschaft des Chromophors bei im übrigen fast gleicher Proteinsequenz eine beträchtliche Verschiebung des Absorptionsmaximums bewirkt: Die beiden neben dem blauempfindlichen Rezeptor (mit einer Absorption bei ca. 420 nm) ebenfalls im Auge des Menschen vorkommenden Rezeptortypen (der grün- und der rotempfindliche Sehfarbstoff mit Maxima bei 535 und bei 570 nm, letzterer von manchen Autoren als Iodopsin bezeichnet) unterscheiden sich nur in 15 Positionen ihrer Aminosäuresequenz und rufen dennoch eine Absorptionsdifferenz von 35 nm hervor. Die hohe Homologie weist darauf hin, daß sich diese beiden Sehfarbstoffe offenbar erst vor relativ kurzer Zeit (in evolutionärem Maßstab) auseinander entwickelt haben. Es ist zu bemerken, daß erst durch das Zusammenwirken von Rezeptoren unterschiedlicher Absorptionsbereiche die Fähigkeit zum Farbensehen auftritt, da erst so die unterschiedlich starke Erregung verschiedener Sehzelltypen neuronal verarbeitet werden kann und zu einem Farbeindruck führt (Farbwahrnehmung). Die nur in der Dämmerung und bei Nacht (skotopisches Sehen) aktiven Stäbchensehzellen geben Lichtreize unterschiedlicher Farben in ihrem Absorptionsbereich nur als Helligkeitsstufen ("Grautöne") wieder. Photorezeption, Retinomotorik.
Sehfarbstoffe
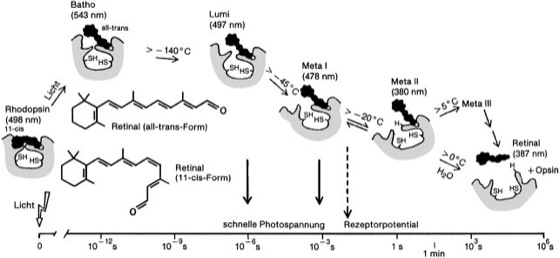
Lichtinduzierte Sehfarbstoffreaktion am Beispiel des Säugetier-Stäbchen-Rhodopsins, das aus der Proteinkomponente Opsin (grau) und dem visuellen Chromophor Retinal (schwarz) zusammengesetzt ist. Das Retinalmolekül liegt im Ruhezustand in der 11-cis-Form vor und geht bei Belichtung in den all-trans-Zustand über. Nur diese erste Reaktion der Rhodopsinbleichung – die Bildung des batho-Produkts – ist lichtabhängig, alle weiteren Schritte laufen im Dunkeln thermisch induziert ab. Die Zeitskala gibt an, nach welchen Zeitspannen die einzelnen Zwischenprodukte gebildet sind. Die Temperaturangaben beziehen sich auf die Mindesttemperaturen, oberhalb derer die Reaktionen möglich sind. Die Bleichung verläuft über mehrere Intermediate, von denen eines (Metarhodopsin II) die Ausbildung eines Protein/Proteinkomplexes mit einem G-Protein (Transducin), dessen Aktivierung und damit die Weiterleitung des visuellen Signals (Signaltransduktion) ermöglicht. Das im letzten Schritt freigesetzte Retinal wird zum größten Teil in den Vitamin-A-Zyklus eingeschleust, ein kleinerer Teil wird noch im Pigmentepithel des Auges nach Reduktion in die 11-cis-Form isomerisiert und steht nach Reoxidation für eine de-novo-Synthese von Rhodopsin zur Verfügung.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.