Synthetische Biologie: Ringschluss bei Proteinen
Schlägt man ein Ei in eine heiße Pfanne, härtet das Eiweiß schnell aus und färbt sich weiß. Das liegt an den darin enthaltenen Proteinen, deren dreidimensionale Struktur sich durch die Hitze irreversibel verändert. Sie denaturieren, wie es im Fachjargon heißt. Proteine sind große Moleküle aus Aminosäureketten, die sich zu einer spezifischen räumlichen Anordnung falten. Wenn ungünstige Umgebungsfaktoren diese zerstören, büßt das Eiweiß seine Funktion ein. Bei biotechnologischen Verfahren in der Industrie, Forschung oder Medizin müssen die Verantwortlichen dies im Blick behalten. Beispielsweise kommt in der Papier- und Textilindustrie das Protein Xylanase zum Einsatz, das einen wesentlichen Bestandteil von pflanzlichen Zellwänden zersetzt. Hitze, extreme pH-Werte oder Lösungsmittel schädigen das Protein – eine höhere Widerstandsfähigkeit wäre deshalb nützlich.
Im Sommer 2014 beschlossen zwölf Heidelberger Studierende, sich mit dem Problem der Stabilisierung von Proteinen auseinanderzusetzen. Die Gruppe suchte nämlich gerade nach einem passenden Forschungsprojekt, um an einem studentischen Nachwuchswettbewerb der iGEM (Abkürzung für International Genetically Engineered Machine) Foundation in Boston, USA, teilzunehmen. Teams aus aller Welt präsentieren dort alljährlich ihre kreative wissenschaftliche Arbeit aus dem Bereich der synthetischen Biologie.
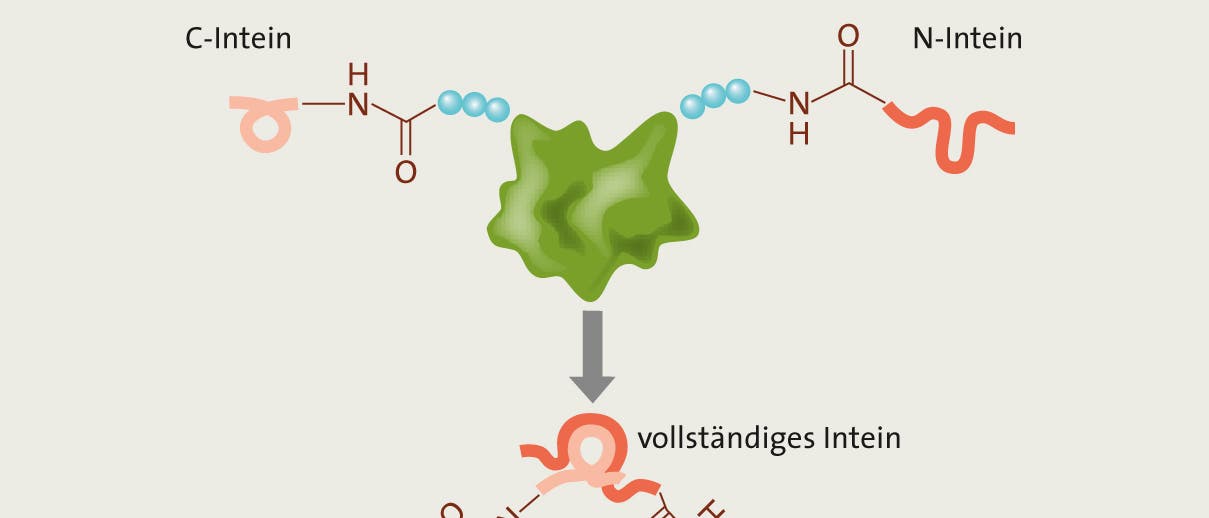
"Bei unserer Recherche stießen wir auf den Vorteil ringförmiger Proteine", berichtet Carolin Schmelas. Gemeinsam mit ihren Kommilitonen stellte sie fest, dass zirkuläre, also ringförmig in sich geschlossene Proteine weniger schnell denaturieren als solche mit zwei offenen Enden, wie sie fast alle in der Natur auftretenden Proteine aufweisen – auch die Xylanase. Mit dieser Erkenntnis begann eine Erfolgsgeschichte. "Wir wollten Eiweiße zu einem Ring verschließen, um sie dadurch widerstandsfähiger zu machen", erinnert sich Schmelas an den Beginn ihres Vorhabens. Und ihre Kollegin Anna Huhn ergänzt: "Die Denaturierung des Proteins beginnt meist an den losen Enden, wie bei einem Wollknäuel, das man von dort aus entrollt. Verknüpft man die Endstücke, stellen diese keine Angriffsfläche mehr dar." ...
Schreiben Sie uns!
Beitrag schreiben