Nobelpreise 2012: Die Sinnesorgane der Zellen
Auch Zellen unterhalten sich – sie verwenden dazu eine Vielzahl chemischer Signalstoffe, die im Inneren der Zelle unterschiedliche Veränderungen von Umbauten des Zytoskeletts bis hin zu veränderter Genaktivität auslösen. Doch die allermeisten Signalstoffe dringen gar nicht durch die Zellmembran hindurch. Wie entfalten sie ihre Wirkung im Inneren?
Diese Frage beantworteten Robert J. Lefkowitz vom Howard Hughes Medical Institute und Brian K. Kobilka von der Stanford University, indem sie eine neue Klasse von Proteinen identifizierten – die G-Protein-gekoppelten Rezeptoren (GPCR). Sie entdeckten damit eine der größten und bedeutendsten Proteinklassen im Organismus, die nahezu überall zu finden ist, wo Signale in die Zelle weitergeleitet werden – ob es nun ein Hormon ist, ein Geschmacksreiz auf der Zunge oder ein Lichtsignal im Auge.
Den ersten dieser Rezeptoren identifizierte Lefkowitz im Jahr 1968. Zu dieser Zeit war bereits bekannt, dass Hormone Signalstoffe sind, die in Zellen bestimmte Reaktionen auslösen, und dass diese Signale im Zellinneren durch eine chemische Kaskade weitergegeben wurden. Doch welches Element beides verbindet, blieb rätselhaft. Lefkowitz arbeitete daran, die dafür zuständigen Rezeptormoleküle zu identifizieren, indem er ein radioaktives Iod-Isotop in verschiedene Hormone einbaute und anhand dieses Signals ihre Andockstellen an der Zelle ausfindig machte.
Auf diese Weise gelang es ihm, einen Rezeptor für Adrenalin, den beta-adrenergen Rezeptor (beta-AR) zu identifizieren, selektiv zu isolieren und aufzureinigen. Die wahre Bedeutung dieses Fundes erschloss sich allerdings erst, als Brian Kobilka zu Beginn der 1980er Jahre die Herausforderung annahm, die für den Adrenalin-Rezeptor kodierenden Gene aufzuspüren. Die Forscher isolierten das vergleichsweise seltene Molekül aus Hamstern, bis sie genug zusammenhatten, um die Aminosäuresequenz auf chemischen Weg zu ermitteln. Diese übersetzten sie in Basenabfolgen der zugehörigen DNA.
Mit den so gewonnenen DNA-Sonden – und einem guten Schuss Glück – rekonstruierten Kobilka und seine Kollegen das komplette Gen für beta-AR – und erlebten eine Überraschung: Ein sehr ähnliches Molekül war bereits bekannt. Teile der Erbgutsequenz stimmten mit der des Rhodopsins überein, einem Sehpigment im menschlichen Auge. Die Forscher schlossen daraus, dass sie eine ganze Rezeptorfamilie vor sich haben, deren Mitglieder alle eine sehr ähnliche grundlegende Struktur haben.
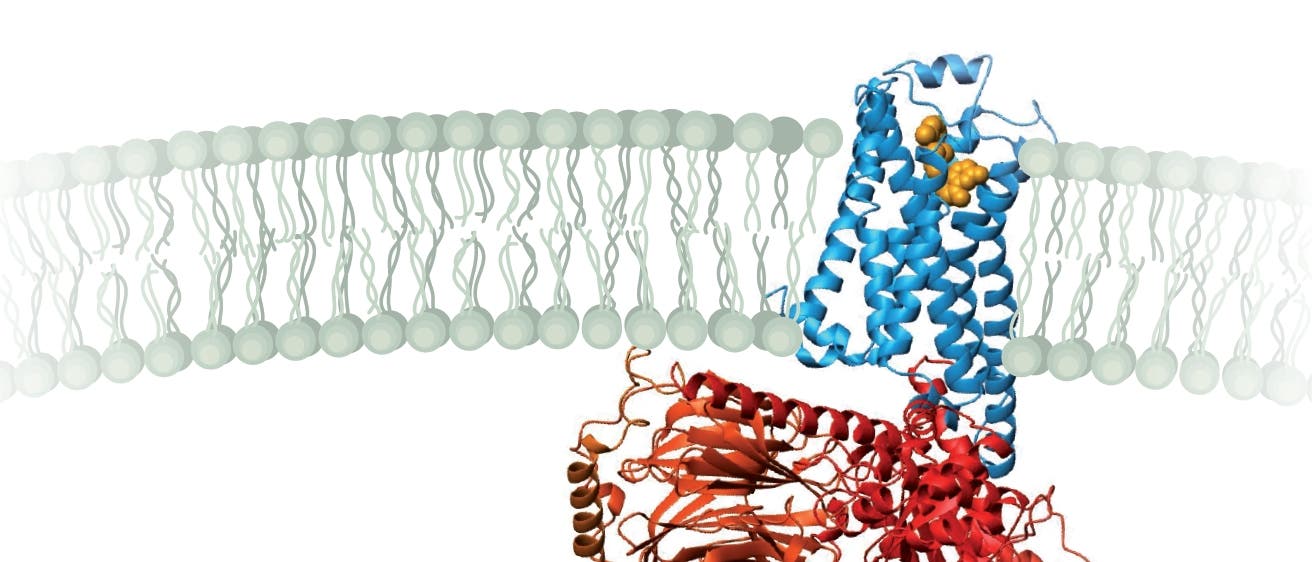
Diese grundlegende Struktur besteht aus sieben Helix-Regionen, die in allen derartigen Proteinen nebeneinander liegend die Zellmembran durchspannen und die eine für den Rezeptor ganz wesentliche Funktion haben: Dieses Stäbchenbündel gibt das Signal, dass außen ein passendes Molekül gebunden ist, nach innen weiter. Tatsächlich ist die Rezeptorfunktion rein mechanisch. GPCR können zwei verschiedene Formen annehmen, eine aktive und eine inaktive Konfiguration. Der Bereich des Proteins, der außerhalb der Zelle liegt, bindet sehr spezifisch einige wenige miteinander verwandte Signalstoffe.
Die anziehenden und abstoßenden Kräfte beim Binden eines dieser Moleküle verändern die Form des Stäbchenbündels und lösen auf der anderen Seite der Membran eine Reaktionskaskade aus. Das Kürzel "G-Protein" steht für Guaninnukleotid bindendes Protein, und diese Eigenschaft ist auch entscheidend für das, was folgt: Sobald ein Ligand an den Rezeptor bindet, katalysiert dieser am G-Protein den Austausch eines gebundenen Guanosindiphosphat-Moleküls gegen Guanosintriphosphat. Durch diese chemische Veränderung zerfällt das G-Protein in drei Untereinheiten, von denen G-alpha das eigentliche Signal weiterleitet: Es bindet an Enzyme, die intrazelluläre Signalstoffe wie cAMP erzeugen.
Dieser Mechanismus gibt nicht nur das Signal weiter, sondern verstärkt es dazu noch erheblich. Der Komplex aus Rezeptor und Signalstoff ist lange genug aktiv, um mehrere G-Proteine nacheinander reagieren zu lassen, und auch im nächsten Schritt bewirkt eine G-Protein-Untereinheit, dass ein weiteres Enzym eine große Menge Signalstoff erzeugt. Dadurch kann schon ein einziges Molekül des ursprünglichen Signalstoffs eine deutliche Reaktion in der Zelle hervorrufen – das System ist hochempfindlich.
Das Herzstück dieses Mechanismus, der aktivierte Komplex aus Ligand, Rezeptor und G-Protein, wurde erst jüngst von einem Forscherteam um Kobilka restlos entschlüsselt: 2011 veröffentlichten sie die hoch aufgelöste Kristallstruktur dieses so genannten ternären Komplexes [1]. Auch hier wartete eine Überraschung auf die Forscher. Die vergleichsweise kleine Verschiebung am äußeren Ende des Rezeptors durch den Liganden verschiebt eine einzelne Helix so stark, dass sich eine tiefe Lücke im GPCR auftut – und in diese gleitet ein Teil des G-Proteins hinein.
Die physiologische Bedeutung der GPCR ist immens – der Mensch besitzt allein etwa 1000 Gene, die solche Rezeptoren kodieren, und ihre Liganden sind alle Arten von inneren und äußeren Signalen: Licht, Geruch, Geschmack und Hormone wie Adrenalin, Serotonin und andere. Deswegen sind sie für die Medizin von entscheidender Bedeutung. Sie stellen etwa die Hälfte aller bekannten Zielstrukturen für Medikamente, zum Beispiel Betablocker oder den antiviralen Wirkstoff Maraviroc, der das HI-Virus daran hindert, über den 7-Helix-Rezeptor CCR5 an seine Wirtszellen anzudocken.

Schreiben Sie uns!
Beitrag schreiben