Evolution: Der Weg zur komplexen Zelle
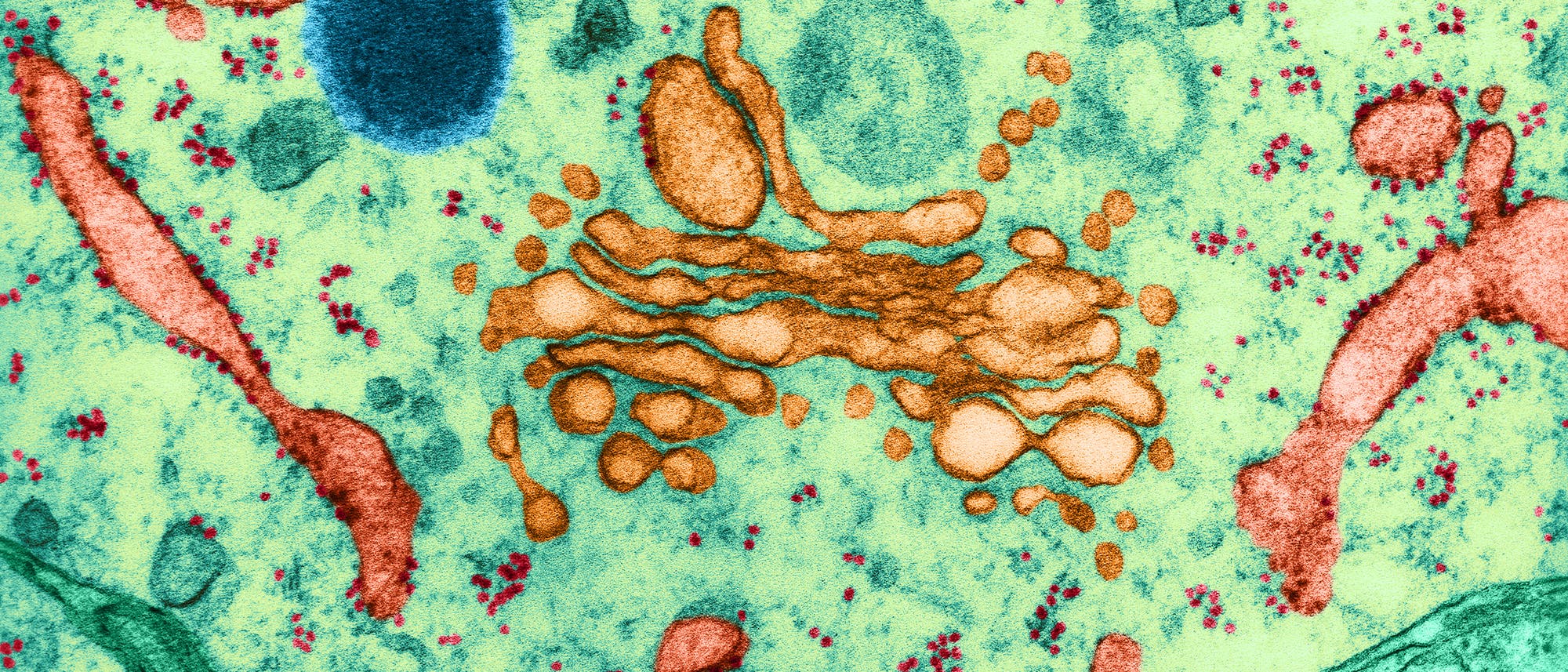
Vor etwa 1,5 Milliarden Jahren fand ein folgenschweres Ereignis statt: Zwei winzige, primitive Zellen vereinigten sich. Kaum etwas – abgesehen von der Entstehung des Lebens selbst – hat den Lauf der Evolution auf unserem Planeten derart einschneidend verändert.
Eine der beiden Zellen landete im Inneren der anderen und entwickelte sich dort zu einer Struktur, die gern als »Kraftwerk der Zelle« bezeichnet wird: zum Mitochondrium. Diese neue Komponente verschaffte dem Wirt einen enormen energetischen Vorteil – und war damit eine Voraussetzung für die spätere Entwicklung von vielzelligem Leben.
Allerdings ist das noch nicht die ganze Geschichte. Denn das Mitochondrium stellt nicht die einzige wichtige Struktur in komplexen, »eukaryotischen« Zellen dar. So gilt ein Kern, der das Genom innerhalb seiner Membran verwahrt, geradezu als deren Charakteristikum. Daneben gibt es eine verwirrende Vielfalt innerer Membranen: das endoplasmatische Retikulum, den Golgi-Apparat, Lysosomen, Peroxisomen und Vakuolen, die für die Herstellung, den Transport und die Wiederverwertung von Proteinen und anderen Materialien in und um die Zelle herum nötig sind. Doch woher kommen all diese Strukturen?
Die Frage lässt sich nur schwer beantworten. Das liegt daran, dass die dazugehörigen evolutionären Ereignisse tief in der Vergangenheit liegen und nur noch wenige Spuren existieren, die als Anhaltspunkte dienen können. Hypothesen dazu gibt es genug, aber erst in den letzten Jahren gelang es Zellbiologen, mithilfe einiger neuer Werkzeuge und Techniken ein wenig mehr über die möglichen Ursprünge der komplizierten Architektur herauszufinden.
Alles begann, als eine Mikrobe eine andere schluckte
Die Idee, dass Eukaryoten aus der Verschmelzung zweier Zellen entstanden sind, ist mehr als 100 Jahre alt. Doch erst als die Evolutionsbiologin Lynn Margulis in den 1960er-Jahren die Theorie der Endosymbiose aufstellte, der zufolge die beiden Organismen ab einem gewissen Zeitpunkt nicht mehr ohne den jeweils anderen überleben konnten, wurde die Ansicht populär und weithin akzeptiert. Das Mitochondrium, so Margulis, stammte vermutlich von einem Mitglied der Alphaproteobakterien ab. Zu dieser vielseitigen Mikrobengruppe gehören heute unter anderem das Bakterium, das Typhus auslöst, sowie eines, das zur gentechnischen Veränderung von Pflanzen eingesetzt wird.
Über die ursprüngliche Wirtszelle war hingegen lange nichts bekannt. Viele Wissenschaftlerinnen und Wissenschaftler vermuteten, dass sie bereits ziemlich komplex war und eine Vielzahl von Membranstrukturen enthielt. Eine solche Zelle wäre in der Lage gewesen, Partikel in sich aufzunehmen – eine komplizierte und energieintensive Funktion eukaryotischer Zellen, die Fachleute Phagozytose nennen. So könnte das Mitochondrium in den Wirt gelangt sein, lautet die Überlegung. Diese »Mitochondrien-Spät-Hypothese« erklärt allerdings nicht, wie oder weshalb die Wirtszelle zuvor schon so komplex werden konnte.
Waren Mitochondrien die ersten Organellen?
Im Jahr 2016 schlugen der Evolutionsbiologe William Martin, der Zellbiologe Sven Gould und der Bioinformatiker Sriram Garg von der Universität Düsseldorf daher ein völlig anderes Modell vor: die »Mitochondrien-Früh-Hypothese«. In ihrer Publikation argumentieren sie, es sei sehr unwahrscheinlich, dass eine Zelle vor mehr als 1,5 Milliarden Jahren bereits über interne Membranstrukturen verfügt habe, da auch heutzutage keine einzige primitive Zelle solche Strukturen aufweist. Stattdessen könnte sich das Endomembransystem – also sämtliche durch Membranen abgetrennte Elemente in komplexen Zellen – erst entwickelt haben, nachdem sich das Alphaproteobakterium in einer relativ einfachen Wirtszelle aus der Gruppe der sogenannten Archaeen eingenistet hatte. Die diversen Membranstrukturen wären aus Blasen oder Vesikeln entstanden, die der Mitochondrienvorläufer freigesetzt hätte.
Das sei nicht ungewöhnlich: Frei lebende Bakterien würden ständig und aus allen möglichen Gründen Bläschen ausscheiden, betonen Gould, Garg und Martin. Es liege folglich nahe, dass sie das auch innerhalb eines Wirts machen. Mit der Zeit hätten sich diese Bläschen auf jene Funktionen spezialisiert, die die verschiedenen Membranstrukturen heute in eukaryotischen Zellen erfüllen. Sie wären sogar mit der Membran der Wirtszelle verschmolzen. Das würde erklären, warum die Plasmamembran von Eukaryoten Lipide enthält, die denen von Bakterien ähneln.
Die Vesikel könnten ursprünglich eine wichtige Funktion gehabt haben, sagt der Biochemiker Dave Speijer von der Universität Amsterdam. Der neue Untermieter der Zelle – der Endosymbiont – hätte hochtoxische Moleküle, sogenannte reaktive Sauerstoffspezies, erzeugt, indem er Fettsäuren oxidierte und zur Energiegewinnung verbrannte. »Diese zerstören alles, besonders im Inneren einer Zelle«, sagt Speijer. Die Zelle hätte Schäden vermieden, indem sie die Stoffe in Vesikel eingeschlossen habe.
Ein Untermieter macht Probleme
Ein weiteres durch den Endosymbionten verursachtes Problem hätten die Membranbarrieren ebenfalls lösen können, so Gould, Garg und Martin. Nach Ankunft des Alphaproteobakteriums hätten sich Teile seiner DNA in wichtige Gene des Wirts eingebaut. Um die dadurch unterbrochenen Anleitungen zur Proteinherstellung zu reparieren, brauchte es eine Maschinerie, die solche fremden Teile – heute Introns genannt – wieder entfernt. Dieses »Spleißen« erfolgt an den Boten-RNA-Kopien der Gene, den direkten Produktionsvorlagen für die Proteine.
»Das ist der Selektionsdruck, der für die Entstehung des Zellkerns verantwortlich ist«William Martin, Evolutionsbiologe
Doch damit entstand eine neue Herausforderung. Die Ribosomen genannten Proteinfabriken arbeiten extrem schnell und fügen für die Eiweißsynthese mehrere Aminosäuren pro Sekunde aneinander. Im Gegensatz dazu braucht es etwa eine Minute, um ein einziges Intron herauszuschneiden. Die Zelle muss demnach die mRNA von den Ribosomen fernhalten, bis der Bauplan korrekt ist. Eine Lösung für das Dilemma lieferte die Membran, die den Zellkern umgibt. Sie dient als räumliche Barriere und ermöglicht es, dass das Spleißen der mRNA im Zellkern abgeschlossen ist, bevor die intronfreie mRNA ins Zytoplasma gelangt und dort abgelesen wird.
»Das ist der Selektionsdruck, der für die Entstehung des Zellkerns verantwortlich ist«, sagt Martin. Um diesen zu bilden, hätten sich die vom Endosymbionten abgesonderten Bläschen abgeflacht und um das Genom gewickelt. So entstand eine Barriere, die die Ribosomen fernhielt, kleine Moleküle dagegen ungehindert passieren ließ.
Die Hypothese von Gould, Garg und Martin erklärt also, weshalb sich Endomembrankompartimente entwickelt haben: um Probleme zu lösen, die durch den neuen Gast entstanden sind. Aber sie helfe nicht zu verstehen, wie das Alphaproteobakterium überhaupt in den Wirt gelangt sei, sagt der Zellbiologe Gautam Dey vom European Molecular Biology Laboratory (EMBL) in Heidelberg. Stattdessen geht die Hypothese davon aus, dass der Endosymbiont bereits im Inneren der Zelle war. »Das ist ein massives Problem«, findet Dey.
Das Inside-out-Modell: Innige Symbiose mit Folgen
Eine alternative Erklärung schlugen der Zellbiologe Buzz Baum (mit dem Dey einst zusammenarbeitete) vom britischen MRC Laboratory of Molecular Biology in Cambridge und sein Cousin, der Evolutionsbiologe David Baum von der University of Wisconsin, USA, im Jahr 2014 vor: das »Inside-out-Modell«. In diesem Szenario haben das Alphaproteobakterium und das Archaeon, das später dessen Wirt werden sollte, bereits Millionen von Jahren in einer innigen Symbiose eng nebeneinander gelebt, wobei jeder von den Stoffwechselprodukten des anderen abhängig war. Die Archaeenzelle hatte lange Ausstülpungen, wie man sie von einigen modernen Archaeen kennt, die eng mit anderen Mikroben zusammenleben. Irgendwann begannen diese Fortsätze, sich um das Alphaproteobakterium zu wickeln, bis sie es schließlich vollständig umschlossen. Doch schon lange davor hatte die Archaeenzelle begonnen, die Arbeit räumlich aufzuteilen: Die informationsverarbeitenden Aufgaben blieben in ihrem Zentrum, wo sich das Genom befand, während andere Funktionen wie die Proteinherstellung innerhalb der Ausstülpungen stattfanden.
Laut Buzz Baum liegt die Stärke des Inside-out-Modells darin, dass die Zellen reichlich Zeit hatten, bevor sie sich das Alphaproteobakterium vollständig einverleibten. Währenddessen konnten sie Mechanismen entwickeln, um die Anzahl und Größe des Mitochondriums und anderer Membrankompartimente zu regulieren, damit die Integration des Mitbewohners keine Gefahr darstellte. Das Modell liefert zudem eine Erklärung für die jetzige Form des Zellkerns, insbesondere für seine ungewöhnlich großen Poren, die sich Baum zufolge aus den langen Ausstülpungen entwickelt haben könnten. Wichtiger ist aber, dass das Inside-out-Modell aufzeigt, wie das Alphaproteobakterium überhaupt in den Archaeen-Wirt gelangen konnte.
Gleichwohl gibt es auch hier noch offene Fragen. So würde das Mitochondrium zunächst an der falschen Stelle landen, nämlich im endoplasmatischen Retikulum, auf dem die proteinproduzierenden Ribosomen der Zelle sitzen. Das heißt, es wäre ein zusätzlicher Schritt nötig, um das Alphaproteobakterium in das Zytoplasma zu bringen. William Martins zentraler Einwand lautet jedoch, dass es im Inside-out-Modell keinen evolutionären Druck gibt, der die Entstehung des Zellkerns oder anderer membrangebundener Kompartimente überhaupt erst ermöglicht hätte.
Der Ursprung des Zellkerns
Während die Modelle darin übereinstimmen, dass sich das Mitochondrium aus einem Alphaproteobakterium entwickelt hat, propagieren sie sehr unterschiedliche Vorstellungen über den Ursprung des Zellkerns und anderer Organellen. Gemäß der These von Gould, Garg und Martin bildeten sich alle Strukturen aus Vesikeln, die das entstehende Mitochondrium freisetzte. Derartige Bläschen, die reaktionsfreudige Moleküle oder für die Zelle wichtige Fracht enthalten und transportieren können, hätten sich demnach sehr früh gebildet. Der Zellkern wäre dagegen erst später aufgetaucht.
Im Inside-out-Modell entstand der Zellkern im Wesentlichen aus der Archeenzelle, nachdem sich deren Membranen um das Alphaproteobakterium gewickelt hatten. Damit hätte es ihn vom Beginn der Vereinigung an gegeben. Auch das endoplasmatische Retikulum hätte sich schon früh aus den zusammengepressten Ausstülpungen geformt. Weitere Organellen hätten sich erst später gebildet – laut Buzz Baum aus abgespaltenen Bläschen der Archaeenmembran.
Entsprechend liefern die Modelle verschiedene Vorhersagen darüber, wie die Membranen von Zellorganellen – zumindest ursprünglich – beschaffen waren. Und wie es dazu kam, dass die komplexen Zellen von heute Membranlipide enthalten, die chemisch denen von Bakterien und nicht denen von Archaeen ähneln. Gemäß der Idee von Gould, Garg und Martin wären am Anfang alle Membranen bakteriellen Ursprungs gewesen, mit Ausnahme der äußersten Membran der Wirtszelle. Dann begannen bakterielle Vesikel mit der Außenmembran des Wirts zu verschmelzen, wodurch die bakteriellen Lipide allmählich die der Archaeen ersetzten.
Im Gegensatz dazu hätten beim Inside-out-Modell die Membranen des Zellkerns und des endoplasmatischen Retikulums – und wahrscheinlich auch andere – anfangs der Außenmembran des Wirts geähnelt. Erst nachdem Gene aus dem bakteriellen Erbgut in das Wirtsgenom gewandert waren, seien die bakteriellen Lipide aufgetaucht.
Wie lassen sich diese Ideen testen?
Mithilfe von Laborexperimenten beginnen Zellbiologen zu erkennen, wie sich einfache Vesikel in verschiedene Organellen mit spezifischen Aufgaben verwandelt haben könnten. Etwa indem die Bläschen unterschiedliche Formen annahmen, wie die geschichteten Membranen des heutigen endoplasmatischen Retikulums oder des Golgi-Apparats. Oder dank einer anderen Proteinzusammensetzung in ihrem Inneren oder auf ihren Membranen.
Es zeigt sich auch, dass Mitochondrien neue Membranstrukturen hervorbringen können – etwa Peroxisomen, die sich laut Speijer schon früh entwickelt haben, um reaktive Sauerstoffspezies zu neutralisieren. Im Jahr 2017 berichtete die Zellbiologin Heidi McBride von der McGill University im kanadischen Montreal, dass Zellen ohne Peroxisomen solche Strukturen von Grund auf neu herstellen können. Dies entdeckte ihr Team bei mutierten menschlichen Fibroblastenzellen ohne Peroxisomen. Die Zellen bauten zwei Proteine, die für die Funktion der Peroxisomen wichtig sind, in die Mitochondrien ein, die sie dann in kleinen Vesikeln freisetzten. Derartige Proto-Peroxisomen verschmolzen mit anderen Bläschen aus dem endoplasmatischen Retikulum, die ein drittes notwendiges Peroxisomen-Protein enthielten. Auf diese Weise entstanden schließlich echte Peroxisomen.
»Die Anwesenheit von Mitochondrien hat die Biogenese neuer Organellen in Gang gesetzt«Heidi McBride, Zellbiologin
Für McBride deutet das darauf hin, dass Peroxisomen – und vermutlich auch andere Organellen – ursprünglich von Mitochondrien abstammen und nicht ausschließlich vom endoplasmatischen Retikulum wie bisher angenommen. »Die Anwesenheit von Mitochondrien hat die Biogenese neuer Organellen in Gang gesetzt«, sagt sie. »Im Fall der Peroxisomen sogar ganz direkt.«
Mitochondrien als Ursprung anderer Strukturen
Und die Mitochondrien haben noch mehr auf Lager: Einer Publikation von 2021 aus dem Labor des Biochemikers Adam Hughes von der University of Utah zufolge scheiden die Mitochondrien von Hefezellen, denen zu große und daher toxische Mengen an Aminosäuren zugeführt werden, Vesikel mit Transportermolekülen ab. Letztere bringen die Aminosäuren ins Innere der Bläschen, wo sie nicht mehr schaden können.
Hughes entdeckte zudem, dass die von den Mitochondrien produzierten Vesikel lange, röhrenförmige Ausläufer mit mehreren Membranschichten bilden können, die an das stapelartige Erscheinungsbild des endoplasmatischen Retikulums und des Golgi-Apparats erinnern. Diese Strukturen bleiben lange Zeit in der Zelle erhalten.
Im Jahr 2022 zeigte die Immunologin Lena Pernas, die jetzt an der University of California in Los Angeles arbeitet: Mehrschichtige, aus den Mitochondrien stammende Strukturen können auch in anderen Zusammenhängen entstehen. Wenn sich eine Zelle mit dem Parasiten Toxoplasma infiziert, umschließen die Mitochondrien den Eindringling und verändern ihre Form, wie ihr Team herausfand. In der Folge sondert das Mitochondrium größere Teile seiner äußeren Membran ab.
Diese Strukturen, die zunächst wie einfache Bläschen aussehen, können wachsen und komplexere Formen annehmen, etwa Stapel aus dünnen Schichten. Überdies beeinflusst der Stress durch die Infektion der Zelle, welche Proteine auf dem Stückchen Mitochondrienmembran sitzen. Damit könnten die gestapelten Lagen neue Aufgaben übernehmen, sagt Pernas.
Je mehr Pernas und Hughes solche Gebilde – die in verschiedensten Zellen und unter ganz unterschiedlichen Bedingungen vorkommen – untersuchten, desto mehr Ähnlichkeiten entdeckten sie. Hughes findet die Vorstellung faszinierend, dass sich eine derartige Struktur, die sehr früh in der Evolution der Eukaryoten entstanden ist, über Jahrmillionen hinweg durch natürliche Selektion zu Komponenten heutiger Zellen entwickelt haben könnte.
Vielleicht werden wir nie mit Sicherheit wissen, was genau damals vor so langer Zeit geschah, als sich zwei urtümliche Zellen zu einem komplexeren Gebilde vereinigten. Aber durch die Erforschung dessen, was in heute lebenden Bakterien, Archaeen und eukaryotischen Zellen vor sich geht, lässt sich zumindest besser verstehen, was theoretisch möglich war – oder sogar wahrscheinlich.

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.