Krebsmedizin: »Immuntherapien haben einen gewaltigen Entwicklungssprung gemacht«
In der Tumormedizin tut sich derzeit viel. Das Fach profitiert von weiterentwickelten Immuntherapien, die Krebserkrankungen mithilfe der Körperabwehr bekämpfen. Von sich reden gemacht hat die CAR-T-Zelltherapie, die T-Zellen des Immunsystems mit künstlichen Rezeptormolekülen namens CAR ausstattet – was die Zellen dazu befähigt, Tumoren wirksam zu attackieren.
Zugleich drängt die Gentechnik voran und wird in der Medizin immer wichtiger. Gegen einige Krankheiten wie die Sichelzellanämie oder die erbliche Netzhautdegeneration sind bereits Gentherapien zugelassen. Die Veränderung des Erbguts erfolgt dabei oft mit CRISPR-Verfahren.
Was geschieht, wenn man beides – CAR-T-Zelltherapien und CRISPR – kombiniert? Gibt das der Krebsmedizin weiteren Aufwind, und wenn ja, wie? Die Mediziner Michael Hudecek und Karl Petri haben darüber mit Spektrum gesprochen.
Herr Professor Hudecek, Herr Petri, Sie beschäftigen sich mit weiterentwickelten CRISPR-Verfahren in der Medizin. Was steckt dahinter?
Petri: CRISPR-Verfahren machen sich einen Immunabwehrmechanismus von Bakterien zunutze. Sie setzen Proteine aus bakteriellen Abwehrsystemen ein, um DNA-Moleküle, die Träger der Erbinformation, hochpräzise zu verändern. Man hat festgestellt, dass das in allen möglichen Zellen funktioniert, auch in denen von Tieren einschließlich des Menschen. Das hat einen Siegeszug eingeläutet sowohl in der Grundlagenforschung als auch bei medizinischen Anwendungen. 2020 gab es dafür den Nobelpreis. 2023 ist dann die erste Gentherapie auf Basis des CRISPR-Verfahrens zugelassen worden: ein Arzneimittel namens Exa-cel, mit dem sich die Sichelzellkrankheit und die β-Thalassämie behandeln lassen, beides angeborene schwere Blutkrankheiten.
Wie wichtig sind CRISPR-Verfahren in der heutigen Medizin?
Petri: Zum einen haben sie einen unglaublichen Nutzen gebracht in der Grundlagenforschung, wo man damit in kurzer Zeit riesige Mengen von zellulären DNA-Molekülen verändern kann. Das eröffnet nie dagewesene Möglichkeiten, biomolekulare Vorgänge aufzuklären. Zum anderen lassen sich damit viele neue Therapieverfahren entwickeln – nicht nur gegen Sichelzellkrankheit und β-Thalassämie, auch gegen andere Erbkrankheiten und Stoffwechselkomplikationen wie die Amyloidose. Es gibt zahllose Anwendungsmöglichkeiten, und mittlerweile laufen viele klinische Studien, die den medizinischen Einsatz von CRISPR-Verfahren testen.
Eine andere Technologie, die in der Medizin gerade für eine Revolution sorgt, sind die sogenannten CAR-T-Zellen.
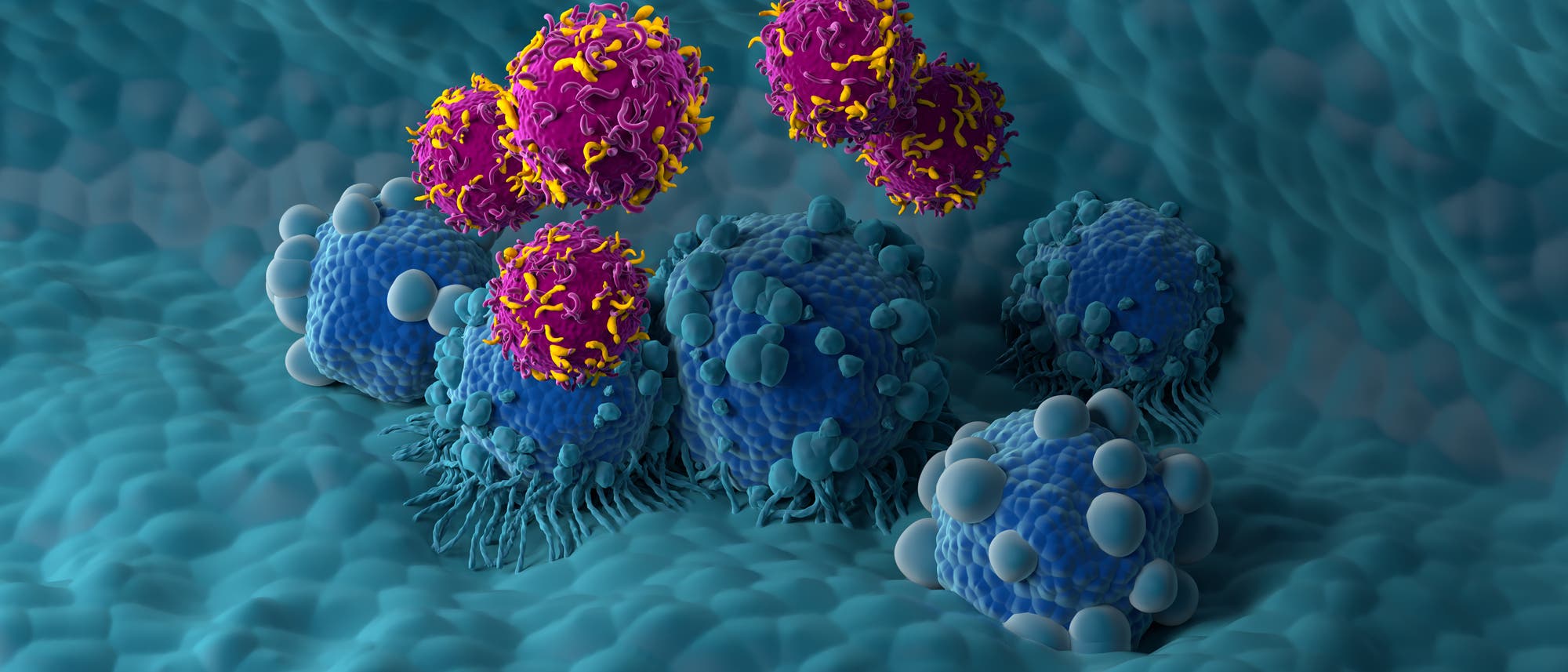
Hudecek: Das sind gentechnisch veränderte Immunzellen, genauer gesagt T-Zellen, die wir so umprogrammieren, dass sie bestimmte Zielstrukturen im Körper des Patienten erkennen und angreifen. Oft geht es dabei um Krebszellen, die attackiert und vernichtet werden sollen. Inzwischen gibt es mehrere zugelassene CAR-T-Zelltherapien; man kann sagen, bei der Behandlung einiger bösartiger Blutkrankheiten ist das mittlerweile ein Routineverfahren. In Deutschland werden sie an vielen – vor allem universitären – Zentren angeboten. Die CAR-T-Zelltherapien, die wir klinisch aktuell nutzen, sind alles autologe Therapien. Das heißt, wir entnehmen Immunzellen aus dem Patienten und programmieren sie außerhalb seines Körpers um, sodass sie ein künstliches Rezeptormolekül herstellen, den sogenannten chimären Antigenrezeptor, abgekürzt CAR. Mit dessen Hilfe erkennen sie eine Oberflächenstruktur auf Tumorzellen. Die so veränderten Immunzellen erhält der Patient dann als Infusion, worauf sie innerhalb seines Organismus einen Angriff auf den Tumor starten.
Sie haben gerade erwähnt, dass die T-Zellen bei dieser Methode gentechnisch verändert werden. Passiert das mithilfe des CRISPR-Verfahrens?
Hudecek: Aktuell nein. Um den genetischen Bauplan für das Rezeptormolekül CAR in die Immunzellen zu schleusen, nutzen wir beispielsweise modifizierte Viren, die sich als Genfähren sehr bewährt haben. Seit einigen Jahren arbeiten wir zudem mit sogenannten Transposons; das sind springende Gene, die wir ins Erbgut der Zelle einbauen. Mit ihnen lässt sich der Bauplan des CAR ebenfalls in die Immunzellen schleusen – das hat den Vorteil, keine modifizierten Viren herstellen zu müssen, was viele Kosten spart. Außerdem kann man damit sehr viel mehr Patienten behandeln. CAR-T-Zelltherapien sind bisher unter anderem gegen Leukämien und Lymphome eingesetzt worden, also gegen Krebserkrankungen des blutbildenden und des lymphatischen Systems. Bei diesen Krankheiten sprechen wir in Deutschland von einigen Tausend Patienten pro Jahr. Wenn wir CAR-T-Zelltherapien künftig aber auch gegen Lungen-, Brust-, Prostata- und Darmkrebs einsetzen wollen, geht es um Zehntausende oder Hunderttausende Patienten jährlich. Die Mengen an gentechnisch veränderten Immunzellen herzustellen, die man braucht, um so viele Menschen zu behandeln, fällt mit viralen Genfähren schwer. Deshalb lautet der nächste Entwicklungsschritt, mit virusfreien Systemen wie springenden Genen zu arbeiten, und hier sind wir mittlerweile schon in der klinischen Testphase angekommen.
Könnte es künftig vorteilhaft sein, CAR-T-Zellen mithilfe von CRISPR-Verfahren herzustellen?
Hudecek: Ja, wenn es beispielsweise darum geht, die genetische Information für den künstlichen Rezeptor an einer ganz bestimmten Stelle ins Erbgut der Zielzelle einzufügen. Die bislang verwendeten Genfähren, ob mit oder ohne Viren, arbeiten da nicht punktgenau. CRISPR-Verfahren hingegen erzeugen zielsicher am jeweils gewünschten Ort im Genom einen DNA-Doppelstrangbruch, und gibt man dann ein DNA-Segment mit dem Bauplan des CAR hinzu, wird es genau dort eingesetzt. Das ist ein Präzisionseingriff, der in bestimmten Situationen von Nutzen sein kann. Und dessen Wirksamkeit sich mit CRISPR 2.0 noch weiter steigern lässt.
Wie das? Was ist CRISPR 2.0?
Hudecek: CRISPR 2.0 sind weiterentwickelte CRISPR-Verfahren. Sie erzeugen beispielsweise nicht, wie das bisherige CRISPR, einen DNA-Doppelstrangbruch im Erbgut der Zielzelle. Sondern sie schreiben an der entsprechenden Stelle lediglich die Gensequenz um – punktuell und gezielt. Sie erlauben es also, den genetischen Code zu editieren. Damit könnte man etwa Gene lahmlegen, die körpereigene Immunzellen in ihrer Funktion bremsen. Die Natur hat in unsere Abwehrzellen solche Bremsen eingebaut, sogenannte Immuncheckpoints, um das Risiko für Autoimmunerkrankungen zu reduzieren. Aber wenn ich eine gentechnisch veränderte T-Zelle erzeuge, die gegen Krebszellen vorgehen soll, dann will ich sie eigentlich nicht an der kurzen Leine halten. Deshalb kann es manchmal sinnvoll sein, in einer CAR-T-Zelle bestimmte Immuncheckpoints auszuschalten, und das lässt sich mit CRISPR 2.0 machen. Man kann damit auch die Verträglichkeit verbessern, etwa wenn die Immunzellen von einem fremden Spender stammen und man mit CRISPR 2.0 spezielle Gene in ihnen abstellt, die für die Immunerkennung wichtig sind. Die Zellen werden dann vom Organismus des Empfängers nicht so schnell wieder abgestoßen.
»Die Erfahrungen sind sehr positiv, und wir können sagen, dass wir bei Erkrankungen des blutbildenden Systems die CAR-T-Zellen jetzt routinemäßig einsetzen«Michael Hudecek, Krebsmediziner
Wie sind die bisherigen klinischen Erfahrungen mit CAR‑T‑Zelltherapien? Haben sich dadurch die Überlebenschancen von Krebspatienten verändert?
Hudecek: Die Erfahrungen sind sehr positiv, und wir können sagen, dass wir bei Erkrankungen des blutbildenden Systems die CAR-T-Zellen jetzt routinemäßig einsetzen. Wir behandeln damit die akute B‑Zell-Leukämie, das ist der häufigste akute Leukämietyp im Kindesalter und kommt auch bei Erwachsenen vor. Ebenso behandeln wir damit B‑Zell-Lymphome, umgangssprachlich als Lymphknotenkrebs bezeichnet, sowie das Multiple Myelom, das auch als Knochenmarkkrebs bekannt ist. Als die CAR-T-Zelltherapien noch neu waren, wurden sie – wie in der klinischen Entwicklung üblich – zunächst als letztes Mittel bei Patientinnen und Patienten eingesetzt, bei denen die herkömmlichen Behandlungsverfahren versagt hatten. Inzwischen aber gelten sie bei all den genannten Erkrankungen mindestens als Teil der Zweitlinientherapie und gehen in klinischen Studien sogar in die Erstlinientherapie über. Ein beträchtlicher Teil der Erkrankten erhält diese neue Behandlungsform mittlerweile anstelle einer herkömmlichen Chemotherapie. Die Wirksamkeit unterscheidet sich zwischen den verschiedenen Erkrankungsarten. Generell kann man jedoch sagen, dass ein sehr großer Teil der Patienten auf diese Immuntherapien anspricht und es bei vielen gelingt, eine dauerhafte komplette Remission (Rückbildung der Krankheit, Anm. d. Red.) zu erreichen.
CAR-T-Zelltherapien helfen aber nicht allen Behandelten. Warum nicht?
Hudecek: Weil sich die Tumorzellen manchmal als resistent erweisen. Einige besitzen eine sogenannte primäre Resistenz, das heißt, sie sprechen auf die Behandlung gar nicht erst an. Das kann sowohl bei Leukämie- als auch bei Lymphom- und Myelomzellen vorkommen. Damit eine T-Zell-Immunreaktion gegen den Krebs entsteht, müssen die Zielmoleküle, die von den künstlich veränderten T-Zellen erkannt werden, in ausreichender Dichte auf den Tumorzellen sitzen. Wenn eine Untergruppe der Tumorzellen relativ wenige dieser Zielmoleküle hat, dann kann es sein, dass solche Zellen von den CAR-T-Zellen nicht vernichtet werden und weiterhin Krankheitssymptome verursachen. Außerdem gibt es Mechanismen der sekundären Resistenz, wenn nach der Behandlung einzelne Tumorzellen übrig bleiben, sich verändern und dabei Mutationen erwerben, die sie gegenüber den CAR-T-Zellen resistent machen. Zu den Vorteilen der CAR-T-Zelltherapie zählt es jedoch, dass man darauf reagieren kann, indem man die gentechnisch veränderten Immunzellen mit weiteren Merkmalen ausstattet – etwa einer zweiten künstlichen Rezeptorsorte, die ein zusätzliches Zielmolekül auf den Tumorzellen erkennt, was die Behandlung wieder wirksamer macht.
»Eigentlich ist die CAR-T-Zelltherapie nicht so teuer, wenn man sich überlegt, was man damit einspart an konventionellen Medikamenten und auch an Infrastrukturnutzung«Michael Hudecek, Krebsmediziner
CAR-T-Zelltherapien sind ziemlich teuer. Könnte sich das künftig ändern, wenn Mediziner den Ansatz weiterentwickeln?
Hudecek: Eine CAR-T-Zelltherapie kostet in Deutschland zwischen 275 000 und 325 000 Euro, je nach Zellprodukt. Was manche daran als schockierend empfinden, ist die Tatsache, dass diese Summe mit einem Mal fällig wird. Schaut man sich andere Therapieformen an, etwa Kombinationstherapien aus einem Antikörper und weiteren Substanzen gegen Knochenmarkkrebs, dann bekommen die Patienten monatlich eine solche Behandlung. In einem Zeitraum von ein bis zwei Jahren kann das ähnlich viel kosten wie eine CAR-T-Zelltherapie, es unterteilt sich eben nur in monatliche Beträge. Eigentlich ist die CAR-T-Zelltherapie nicht so teuer, wenn man sich überlegt, was man damit an konventionellen Medikamenten und auch an Infrastrukturnutzung einspart. Behandelt man etwa eine akute Leukämie mit einer Knochenmarktransplantation, muss der Patient mehrere Wochen auf Isolierstation und bekommt über einen langen Zeitraum hinweg begleitende Chemotherapien. Das kann sich auf insgesamt über eine Million Euro summieren, aber das Geld wird eben nicht auf einen Schlag fällig, sondern in Monatsscheiben. Früh und konsequent eingesetzt, können CAR-T-Zelltherapien daher auch für das Gesundheitssystem vorteilhaft sein. Und wenn wir die entsprechenden Therapien in Deutschland entwickeln, die Zellprodukte im Inland herstellen und dafür eine Unternehmensinfrastruktur aufbauen, ist das außerdem ein wichtiger Wirtschafts- und Standortfaktor.
Welche gesundheitlichen Risiken verbinden sich mit einer CAR‑T‑Zelltherapie?
Petri: Die möglichen Nebenwirkungen sind vor allem immunologischer Art – beispielsweise, wenn die Behandlung eine überschießende, schwer kontrollierbare Immunreaktion auslöst. Das versucht man mit einer Weiterentwicklung des Verfahrens besser in den Griff zu bekommen. Beispielsweise, indem man die gentechnisch veränderten Immunzellen mit einem molekularen Sicherheitsschalter ausstattet, über den man sie notfalls deaktivieren kann, indem man bestimmte Antikörper hinzugibt. In den zurückliegenden Jahren war zudem die Rede davon, dass diese Zelltherapien ihrerseits sogenannte sekundäre Tumorerkrankungen verursachen könnten. Das ist nicht völlig überraschend: Auch die klassischen Behandlungsverfahren wie Chemo- oder Strahlentherapien bergen ein gewisses Risiko, ihrerseits eine Krebserkrankung auszulösen. Es gibt Fälle, in denen es infolge einer CAR-T-Zelltherapie zu einer sekundären Tumorerkrankung kommt, etwa wenn sich in einigen der veränderten Immunzellen das Erbgut ungünstig umstrukturiert hat. Das passiert aber sehr, sehr selten. In den vergangenen Jahren ist das intensiv untersucht worden, und die Fachleute kommen zu dem Schluss, dass die Wahrscheinlichkeit einer solchen Komplikation äußerst gering ist. Jedenfalls wäre es in keiner Weise sinnvoll, deswegen auf die Therapie zu verzichten und die primäre Krebserkrankung unbehandelt zu lassen.
Wie schätzen Sie die Zukunft der Krebsmedizin ein? Werden Immuntherapien eine immer größere Rolle spielen?
Hudecek: Davon gehen wir fest aus. In den zurückliegenden Jahren haben viele dieser Verfahren einen gewaltigen Sprung gemacht – von hochexperimentellen Ansätzen hin zu zugelassenen Therapieverfahren. Mit CAR-T-Zelltherapien haben wir große Behandlungserfolge gegen Krebserkrankungen des blutbildenden und lymphatischen Systems erzielt. Wir versuchen das jetzt auf Organtumoren (solche mit festem Platz im Körper, Anm. d. Red.) auszuweiten. Dafür müssen wir den gentechnisch veränderten Immunzellen noch weitere Qualitäten mitgeben. Die Zellen müssen in der Lage sein, in die Tumormasse einzudringen und das bösartige Gewebe zu attackieren. Zugleich müssen sie gesundes Gewebe verschonen. Hier eine gute Balance zwischen Wirkung und Verträglichkeit zu erreichen, ist nicht einfach, aber ich bin fest überzeugt, dass wir diesen Durchbruch schaffen werden. Auch jenseits von Krebserkrankungen deuten sich etliche Anwendungsfelder für CAR-T-Zelltherapien an. Sie haben sich bereits gegen Autoimmunerkrankungen als wirksam erwiesen, ebenso gegen Pilzerkrankungen der Lunge oder gegen pathologische Vernarbungen des Herzgewebes.
In diesem Zusammenhang hört man oft von »Zelltherapien von der Stange«. Was ist das?
Petri: Wie Herr Hudecek vorhin erläutert hat, sind die derzeit zugelassenen CAR-T-Zelltherapien autologe Therapien. Das heißt, man entnimmt die Immunzellen aus dem jeweils zu behandelnden Patienten, verändert sie gentechnisch und gibt sie demselben Patienten dann zurück. Weil man das für jeden Menschen individuell machen muss, ist das sehr aufwendig. Ein wesentliches Ziel der CRISPR-Verfahren war daher immer, sogenannte allogene Zelltherapien zu ermöglichen. Das sind Therapieansätze, bei denen man Zellen aus gesunden Spendern entnimmt und dann mit CRISPR-Verfahren so verändert, dass man aus ihnen CAR-T-Zellen macht, die sich vielen verschiedenen Patientinnen und Patienten verabreichen lassen. Ein großes Problem dabei sind Abstoßungsreaktionen zwischen den Spenderzellen und dem Organismus des Empfängers. Um die zu unterbinden, sind CRISPR-Verfahren sehr nützlich, weil man damit gezielt Gene und ihre Proteinprodukte ausschalten kann, die solche Abstoßungsreaktionen vermitteln.
Was sind denn die Vorteile einer allogenen Zelltherapie?
Petri: Die Therapie muss nicht für jeden Menschen einzeln aufgesetzt werden, sondern man nimmt die Zellen einer spendenden Person und erzeugt daraus ein Zellprodukt, das sich anschließend in großen Mengen produzieren und vielseitig einsetzen lässt. Das würde eine solche Therapie deutlich kostengünstiger machen, und es würde eine raschere Behandlung erlauben, weil man das Zellprodukt nicht jedes Mal neu herstellen muss. Möglicherweise lässt sich dieser Produktionsprozess aber auch komplett umgehen.
Wie?
Petri: Mit einer In-vivo-CAR-T-Zelltherapie, also einer Zelltherapie von innen. Dabei verändert man die Immunzellen direkt im Körper des Patienten. Das ist beispielsweise möglich, indem man virale Genfähren in den Körper spritzt, wo sie den Bauplan des CAR-Proteins in die Immunzellen schleusen. Oder indem man winzige RNA-Schnipsel mit der Bauanleitung des CAR per Nanopartikeln in den Körper einbringt, wo Immunzellen sie aufnehmen und anschließend den künstlichen Rezeptor herstellen. Das ist ein neuer Ansatz, den Mediziner gerade in mehreren klinischen Studien erproben.
Wie aussichtsreich sind diese Ideen?
Petri: Es ist zu früh, um das zu bewerten, weil die klinischen Studien dazu noch laufen. Bisher hat keine allogene CAR-T-Zelltherapie die Zulassung erhalten. Was In-vivo-CAR-T-Zelltherapien betrifft, muss man differenzieren. Es gibt vielversprechende erste Ergebnisse damit, CRISPR-Komponenten mithilfe von Lipid-Nanopartikeln in den Organismus einzubringen, um genetische Erkrankungen zu behandeln. Das könnte sich gegen angeborene Stoffwechselerkrankungen bewähren. Erste Ergebnisse dazu sind verheißungsvoll, aber wir müssen die klinische Testphase abwarten. Und es könnte irgendwann auch eine In-vivo-CAR-T-Zelltherapie ermöglichen. Das wird jetzt intensiv untersucht.
Vorhin war die Rede davon, dass CRISPR 2.0-Verfahren viel feinere gentechnische Eingriffe erlauben als bislang möglich. Wie funktioniert das genau?
Petri: CRISPR 2.0 erzeugt keinen Doppelstrangbruch mehr in der DNA, wie das bei herkömmlichen CRISPR-Verfahren der Fall ist, sondern schneidet nur einen der beiden Stränge. Man gibt dann spezielle Enzyme hinzu, die diesen Strang gezielt umschreiben und dort beispielsweise eine einzelne Base austauschen. Die Reparaturmechanismen der Zelle fügen die Veränderung anschließend auch auf dem zweiten Strang ein.
Ist das sicherer als der frühere Ansatz?
Petri: Der Doppelstrangbruch durch herkömmliche CRISPR-Verfahren kann schwer kontrollierbare Folgen haben. Er kann dazu führen, dass größere Teile des Genoms quasi verloren gehen, im Extremfall sogar ganze Chromosomenarme. Es kann zu sogenannten Translokationen kommen, also quasi zu Verbindungen zwischen Chromosomen, die es normalerweise so nicht gibt. Das sind unerwünschte Effekte, die mit CRISPR 2.0 deutlich seltener auftreten sollten, weil eben nur ein einzelner DNA-Strang verändert wird – was die Wahrscheinlichkeit einer größeren Umstrukturierung innerhalb des Erbguts stark senkt. CRISPR 2.0 sollte daher mit einer höheren Anwendungssicherheit einhergehen.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.