Energietechnik: Käfig für Klimakiller
© Science / AAAS (Ausschnitt)
© Science / AAAS (Ausschnitt)
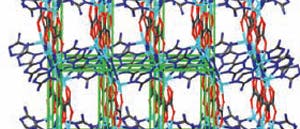
Dreidimensionale Struktur des Kohlendioxid-Absorbers | In dem untersuchten Absorber sind Zinkatome über organische Moleküle – Amitrol und Oxalat – zu einer Struktur mit großen, kanalartigen Hohlräumen vernetzt.
Gesucht wird deshalb ein Material, welches das Gas aufnimmt wie ein Schwamm, es aber nur schwach bindet und leicht wieder abgibt. Aussichtsreiche Kandidaten sind metallorganische Gerüstverbindungen. Wie sie Kohlendioxid festhalten, hat ein Team um Tom Woo von der University of Ottawa (Kanada) nun an einem Beispiel per Röntgenbeugung untersucht.
Dabei handelt sich um einen Festkörper, in dem Metallatome durch molekulare Abstandhalter zu einer porösen Struktur vernetzt sind. Die Hohlräume enthalten Amine in Form der Verbindung Amitrol. Wie sich zeigte, reagiert das Kohlendioxid mit ihnen nicht wie sonst üblich zum Carbamat, sondern wird nur schwach über elektrostatische Wechselwirkungen und Wasserstoffbrücken gebunden, so dass es sich leicht wieder ablöst.
© Science / AAAS (Ausschnitt)
Speicherung des Kohlendioxids im Absorber | Im Absorber hält die Verbindung Amitrol ein Molekül Kohlendioxid (CO2) fest (a). Das geschieht über eine elektrostatische Wechselwirkung mit seiner Amingruppe (gestrichelte violette Linie). Das erste Kohlendioxidmolekül bindet ein zweites (b) – ebenfalls über eine elektrostatische Interaktion (gelbe gestrichelte Linie). Auch andere Wechselwirkungen spielen eine Rolle (c). In der Grafik sind Kohlenstoff grau, Sauerstoff rot, Stickstoff blau, Wasserstoff violett und Zink türkis dargestellt.
Lars Fischer / Manuela Kuhar
Schreiben Sie uns!
Beitrag schreiben