Nobelpreis für Physiologie oder Medizin 2025: Wächter des Immunsystems
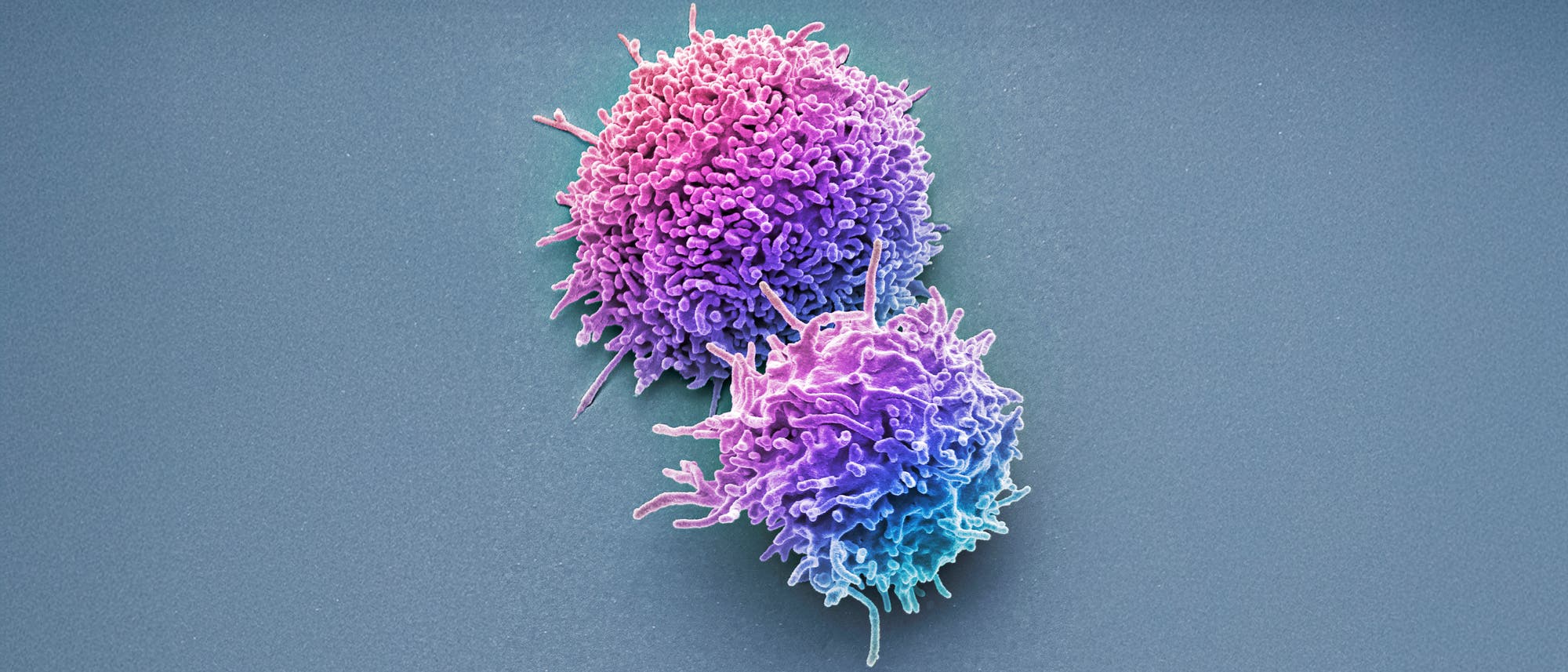
Wahrscheinlich schlummerten Mary E. Brunkow und Fred Ramsdell tief, als die diesjährigen Nobelpreis-Laureaten in Stockholm verkündet wurden. In Seattle und San Francisco war es um 11:30 Uhr Stockholmer Zeit noch mitten in der Nacht. Das Nobelpreiskomitee hatte kurz zuvor vergeblich versucht, die zwei Forscher zu erreichen. Brunkow hielt den Anruf aus Schweden für Spam und schaltete das Telefon aus, wie sie später erzählte. Die beiden hatten offensichtlich nicht damit gerechnet, mit dem diesjährigen Nobelpreis für Physiologie oder Medizin ausgezeichnet zu werden. Erreichbar war lediglich der dritte Preisträger, Shimon Sakaguchi von der Universität Osaka in Japan.
Auch andere dürften den Nobelpreis als eher überraschend empfunden haben. Schließlich haben die gewürdigten Erkenntnisse der drei Forscher nicht zu bahnbrechenden medizinischen Anwendungen geführt, wie die 2023 ausgezeichneten mRNA-Impfstoffe oder andere Forschungen, die im Vorfeld als Kandidaten für den Preis gehandelt wurden. Noch nicht. Denn ein genauerer Blick auf die Forschungen von Brunkow, Ramsdell und Sakaguchi auf dem hochkomplexen Feld der Immunologie zeigt: Die Entdeckung einer neuen Art von Immunzellen, der sogenannten regulatorischen T-Zellen, revolutionierte das Verständnis von Autoimmunreaktionen. Zudem eröffnete sie noch unabsehbare neue Chancen für die Heilung schwerster Krankheiten – von Autoimmunerkrankungen wie multiple Sklerose, Diabetes Typ I und Rheuma bis hin zu Krebs – sowie für die Transplantationsmedizin.
Ohne Immunsystem kein Überleben
Tagein, tagaus muss unser Körper Mikroben, Viren und entartete Zellen erkennen und ausschalten, damit wir nicht alsbald das Zeitliche segnen. Das ist die Aufgabe des Immunsystems. Dessen Komplexität und die Vielfalt seiner Komponenten bringt Medizin- und Biologiestudenten regelmäßig zur Verzweiflung. Die nobelpreisgekrönte Forschung bezog sich allerdings nur auf eine ganz spezifische Klasse von Immunzellen: die T-Lymphozyten, auch T-Zellen genannt. Grob gesagt patrouillieren T-Zellen im Körper, entdecken unerwünschte Eindringlinge und sorgen für deren gezielte Bekämpfung.
Zwischen dem 6. und dem 13. Oktober geben die Nobelkomitees die Preisträger des Jahres 2025 bekannt. Auf unserer Themenseite »Nobelpreise – die höchste Auszeichnung« erfahren Sie, wer einen der renommierten Preise erhalten hat. Dort können Sie außerdem das Wesentliche über die Laureaten und ihre Forschung nachlesen.
Eine Billiarde Antigenrezeptoren
In der umhüllenden Außenmembran der T-Zellen sitzen hochspezifische Antennenmoleküle (Rezeptoren), mit denen sie sich an ein Proteinbruchstück (Antigen) des Feinds anheften können. Aber woher weiß der Körper, welche Antigene ihm im Lauf seines Lebens begegnen werden? Ganz einfach: Er weiß es nicht. Deshalb setzt er auf Vorsorge durch Vielfalt. Antigenrezeptoren bestehen aus zwei verschiedenen Aminosäureketten, die sich wiederum jeweils von einer Vielzahl verschiedener Gene ableiten können. Theoretisch sind so mindestens eine Billiarde verschiedene Kombinationen möglich, eine unvorstellbare Zahl. Einer der Rezeptoren wird also schon passen.
Die Krux an der Geschichte: Auch Zellen des körpereigenen Gewebes haben Antigene an ihrer Oberfläche. Wie also wird verhindert, dass das Immunsystem den eigenen Körper angreift? Lange dachte man, der alleinige Schlüssel liege in der »zentralen Immuntoleranz«, die im Thymus erworben wird. Dort reifen die T-Zellen aus, weshalb sie auch so heißen. Der Thymus präsentiert ihnen körpereigene Antigene, und jene T-Zellen, deren Rezeptoren dazu passen, werden zerstört. Allerdings überleben einige davon augenscheinlich den Säuberungsprozess, werden freigesetzt und könnten danach körpereigenes Gewebe angreifen.
Als das Forschungsfeld kollabierte
Die Forschungsgemeinschaft der Immunologen postulierte schon früh, dass es spezialisierte Immunzellen geben muss, die Autoimmunreaktionen unterdrücken. Aber derartige Suppressor-T-Zellen ließen sich einfach nicht dingfest machen. Der anfängliche Enthusiasmus zerstob. »Das ganze Forschungsfeld kollabierte«, schreiben Gunilla Karlsson Hedestam und Olle Kämpe vom Nobelkomitee in ihrer ausführlichen Presseinformation.
Doch da kam Anfang der 1980er Jahre der Immunologe Shimon Sakaguchi ins Spiel. Bereits 1969 hatten zwei seiner Landsleute am Aichi Cancer Center Research Institute entdeckt, dass drei Tage alte Mäusebabys, denen man die Thymusdrüse entfernt hatte, heftigste Autoimmunreaktionen entwickelten. Kein Wunder: Ohne die Ausmerzung autoaggressiver T-Zellen läuft das Immunsystem Amok.
Als Sakaguchi, der inzwischen ebenfalls an dem japanischen Krebsforschungsinstitut forschte, solchen thymusfreien Mäusen jedoch eine T-Zellen-Mischung von gesunden Mäusen spritzte, blieben die Autoimmunreaktionen aus. In der Mixtur mussten sich demnach Zellen befinden, welche die Immunreaktion unterdrückten, und das außerhalb des Thymus. Die zentrale Immuntoleranz war also definitiv nur die halbe Wahrheit. Doch wie kann man diese Zellen zweifelsfrei identifizieren? Um seine Hypothese zu überprüfen, musste Sakaguchi den mühsamen Weg gehen, zwischen den verschiedenen T-Zellen-Populationen zu unterscheiden.
Mehr als zehn Jahre später, 1995, stellte Sakaguchis Team der Welt dann eine völlig neue Klasse von T-Zellen vor: Sie tragen auf ihrer Oberfläche unter anderem ein Protein namens CD25, das einen Teil des Rezeptors für den Immunbotenstoff Interleukin-2 darstellt. Er nannte sie regulatorische T-Zellen. »Es ist die große Leistung von Sakaguchi, dass er drangeblieben ist und die regulatorischen T-Zellen entdeckt hat, trotz großer Skepsis in der Fachwelt«, sagte der Immunologe Carsten Watzl von der Technischen Universität Dortmund gegenüber der Deutschen Presseagentur (dpa).
Doch CD25 ist nicht das Einzige, was diese Zellen besonders macht: Ihre Existenz hängt offenbar entscheidend vom Funktionieren eines einzigen Gens ab. Damit betreten Mary Brunkow und Fred Ramsdell die Bühne; Brunkow ist heute am Institute for Systems Biology in Seattle, Ramsdell für das Biotechnologie-Unternehmen Sonoma Biotherapeutics in San Francisco tätig. Die beiden Immunologen forschten mit Mäusen, die eine interessante Vorgeschichte hatten: Die Linie stammte ursprünglich aus einem Labor in den 1940er Jahren, in dem man die Auswirkung von radioaktiver Strahlung untersucht hatte. Einige männliche Mäuse wurden mit schuppiger Haut, einer extrem vergrößerten Milz sowie vergrößerten Lymphknoten geboren. Aus irgendeinem Grund schien eine bis dato unbekannte Mutation eine Rebellion des Immunsystems auszulösen. Die bedauernswerten Tiere lebten nur wenige Wochen.
Die Entdeckung von Foxp3
Mary Brunkow und Fred Ramsdell arbeiteten damals bei einem Biotech-Unternehmen, das Arzneimittel für Autoimmunkrankheiten entwickelte. Deshalb hatte der Mäusestamm mit dem Namen Scurfy (englisch für: schorfig) ihr Interesse erregt, und sie machten sich auf die Suche nach dem mutierten Gen bei den Nagern mit der schuppigen Haut. Nur männliche Mäuse waren betroffen, daher lag die Vermutung nahe, dass die Mutation auf dem X-Chromosom liegt. Weibchen, die bekanntermaßen zwei X-Chromosomen besitzen, konnten demnach mit der mutmaßlichen Mutation leben, wenn eines der X-Chromosomen gesunde DNA beherbergte. Die Hälfte ihrer männlichen Nachkommen war dagegen krank.
Die Suche nach dem mutierten Gen der schorfigen Mäuse zog sich hin. Heute ist es möglich, das gesamte Genom einer Maus zu entschlüsseln – und ein mutiertes Gen innerhalb kurzer Zeit zu finden. Doch in den 1990er Jahren war das noch eine sehr mühsame und zeitraubende Angelegenheit. Der DNA-Strang des X-Chromosoms der Maus besteht immerhin aus rund 170 Millionen Nukleotiden! Zunächst grenzten Brunkow und Ramsdell den Ort der Scurfy-Mutation ein, von irgendwo in der Mitte des X-Chromosoms auf rund 500 000 Nukleotide und schließlich auf 20 potenzielle Gene.
Diese untersuchten sie nacheinander, bis sie endlich den schuldigen DNA-Abschnitt gefunden hatten. Das fehlerhafte Gen war zuvor unbekannt gewesen, wies aber viele Ähnlichkeiten mit den so genannten Forkhead-Box- oder FOX-Genen auf. Die von ihnen codierten Proteine kontrollieren als Transkriptionsfaktoren die Aktivität anderer Gene. Mary Brunkow und Fred Ramsdell nannten das neue Gen Foxp3.
IPEX – die menschliche Version der schorfigen Mäusekrankheit
Brunkow und Ramsdell hatten bereits früh den Verdacht geäußert, dass eine seltene Autoimmunkrankheit namens IPEX das menschliche Gegenstück der schorfigen Mäusekrankheit darstellt. Sie führt unter anderem zur Entzündung des Darms und durch den anhaltenden Durchfall zu Mangelernährung und zu einer Wachstumsverzögerung. Kinderärzte aus der ganzen Welt schickten Proben von betroffenen Jungen. Tatsächlich: Auch bei IPEX sitzt die schädliche Mutation im Foxp3-Gen. Im Jahr 2001 publizierten Mary Brunkow und Fred Ramsdell schließlich zusammen mit anderen Forschern in »Nature Genetics« in mehreren Artikeln ihre Erkenntnis, dass Mutationen im Foxp3-Gen sowohl die menschliche Krankheit IPEX als auch die Erkrankung der schorfigen Mäuse verursachen können.
Zwei Jahre später konnte Shimon Sakaguchi die beiden Fäden zusammenführen und überzeugend beweisen, dass der Transkriptionsfaktor Foxp3 die Umwandlung von T-Zellen in regulatorische T-Zellen steuert und dafür unersetzlich ist. Fred Ramsdells Team bewies unterdessen, dass die Scurfy-Mäuse keine regulatorischen T-Zellen besitzen und dass Mäuse, bei denen Foxp3 übermäßig aktiv ist, besonders viele regulatorische T-Zellen besitzen.
Was die Entdeckungen so einzigartig macht: Das Fehlen eines einzigen Zelltyps (regulatorische T-Zellen), ausgelöst durch ein einziges fehlerhaftes Gen (Foxp3), reichte offenbar aus, um die Immuntoleranz zu zerstören. Wie genau die regulatorischen T-Zellen andere T-Zellen hemmen, wird inzwischen intensiv erforscht. Offenbar bremsen sie die Vermehrung normaler T-Zellen und schütten hierzu unter anderem entsprechend wirkende Zytokine aus.
Mehr als 200 klinische Studien
Mehr als 200 laufende klinische Studien stützen sich laut dem Nobelkomitee auf die Erkenntnisse von Mary E. Brunkow, Fred Ramsdell und Shimon Sakaguchi – darunter solche zu häufigen Krankheiten wie Asthma und chronisch-entzündliche Darmerkrankungen. Ein Vermehren, Aktivieren, Modifizieren oder Ausschalten von regulatorischen T-Zellen könnte bei einer Vielzahl medizinischer Probleme nützlich sein. Denn die Zellklasse ist eben nicht nur für die Ausbildung der Selbsttoleranz essenziell und damit für das Verständnis von Autoimmunreaktionen. Regulatorische T-Zellen verhindern vermutlich auch, dass der Fötus während der Schwangerschaft abgestoßen wird. Möglicherweise kontrollieren sie zudem exzessive Immunantworten, wie sie bei Covid-19 beobachtet wurden.
Nicht zuletzt könnte die gezielte Deaktivierung der regulatorischen T-Zellen helfen, Krebstumoren zu bekämpfen. Denn ohne die supprimierenden Zellen kann das Immunsystem die körpereigenen, aber entarteten Krebszellen womöglich besser zerstören. Angesichts der vielfältigen Anwendungsmöglichkeiten wirkt es somit seinerseits überraschend, dass die Nobel-Laureaten wohl nicht mit der Auszeichnung gerechnet hatten.

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.