Gene Editing: Die 5 wichtigsten Fragen zu CRISPR/Cas9
In der Gentechnik wachsen die Bäume wieder in den Himmel. Ein Jahrzehnt nach dem Humangenomprojekt - bei dem die Erwartungen an Ergebnisse sich als überzogen erwiesen - winkt eine neue Technik wieder mit vermeintlicher Erbgut-Allmacht. CRISPR/Cas9 heißt der Hoffnungsträger - eine Genschere, die mit zuvor unerreichter Genauigkeit die DNA an frei wählbaren Punkten manipuliert. Schon jetzt revolutioniert das Verfahren alle Bereiche der Gentechnik, ein Nobelpreis für die Entdeckerinnen gilt als ausgemachte Sache. Doch auch das neue Verfahren ist nicht frei von Fallstricken: Unerwünschte Nebeneffekte, technische Grenzen und sogar Anwälte schränken den Nutzen des Gene-Editing-Systems deutlich ein.
Wie funktioniert CRISPR/Cas9?
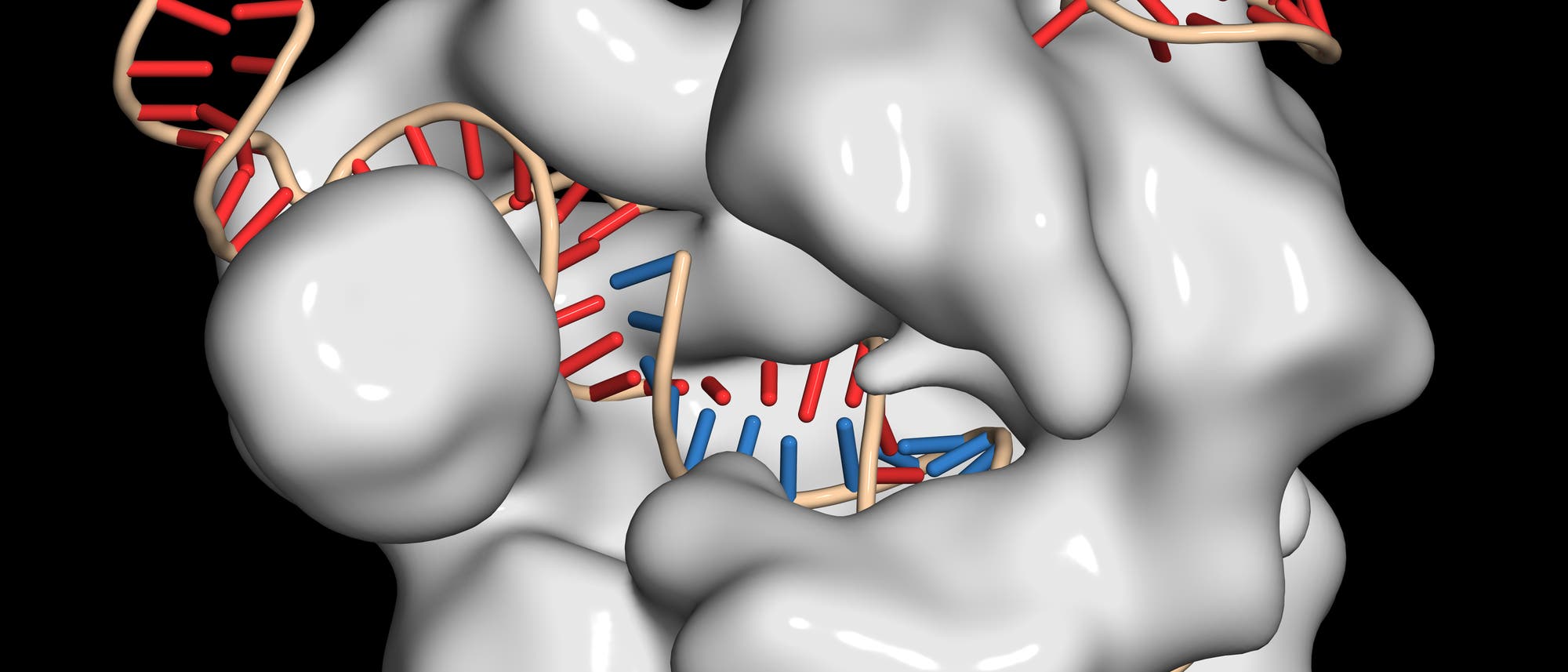
Das CRISPR/Cas9-System, das derzeit die Gentechnik von Grund auf verändert, nimmt Anleihen bei einem ausgeklügelten bakteriellen Immunsystem, das vor Viren schützt. Es basiert auf einer adaptiven Immunabwehr, die sich DNA-Sequenzen der Erreger "merkt" und bei einer erneuten Infektion deren DNA zerschneidet.
Diese Kombination aus Erkennen und Schneiden macht man sich beim Gene Editing zu Nutze. Bei der einfachsten Variante injiziert man RNA in die Zelle, die ein Protein namens Cas9 und eine beliebige Erkennungssequenz kodiert. Die Zelle stellt anhand der RNA das Protein her, dieses findet die beigefügte Erkennungs-RNA und geht an die Arbeit: Cas9 schneidet doppelsträngige DNA - und zwar genau an der Stelle, die ihm das assoziierte RNA-Stück vorgibt. Da man RNA mit einer beliebigen Sequenz künstlich herstellen kann, schneidet eine solche Kombination jedes beliebige Genom an jeder beliebigen Stelle, zumindest theoretisch.
Bereits seit den 1980er Jahren kennt man die so genannten CRISPR-Sequenzen im Erbgut: Die Abkürzung steht für "clustered regularly interspaced short palindromic repeats", also kurze palindromische Wiederholungssequenzen, die durch andere Erbgutstücke getrennt sind und im Genom an bestimmten Stellen gehäuft auftreten. Die Erbgutstücke zwischen den wiederholten Sequenzen, stellte sich dann heraus, stammen oft von Viren - ein Indiz, dass die CRISPR Teil eines antiviralen Systems sein könnten.
In der Nähe der CRISPR fand man später bei allen Bakterien mit diesem System die CRISPR-assoziierten Gene, Cas genannt. Sie sind das entscheidende Element des antiviralen Systems. Das CRISPR-System "erntet" virale DNA und integriert Stücke von ihr zwischen den Wiederholungssequenzen ins bakterielle Erbgut. Dadurch produziert die Zelle RNA-Gegenstücke zur Virus-DNA, die sich mit den Cas-Proteinen zusammenfindet. Versucht ein Virus mit dieser DNA die Zelle noch einmal zu infizieren, "erkennt" die RNA das Viren-Genom: Die Cas-Proteine zerschneiden dann das virale Erbgut, so dass es keinen Schaden mehr anrichtet.
Ursprung des Gene Editing ist die Erkenntnis, dass die Cas-Proteine jede beliebige DNA zerschneiden, sofern man ihnen die passende Erkennungs-RNA mitgibt. Mehr macht CRISPR/Cas9 auch nicht: Nach dem Schnitt verlässt man sich auf die natürlichen Reparaturmechanismen der Zelle, die nun von selbst zum Tragen kommen.
Sind in diesem Augenblick nur die beiden getrennten Teile des Erbguts vorhanden, greift ein zellulärer Reparaturmechanismus, der sie wieder zusammenfügt - der aber ist oft unpräzise und produziert zufällig so genannte Indels, kleine DNA-Stücke, die an der Schnittstelle eingefügt oder ausgeschnitten werden und Gene unter Umständen unbrauchbar machen. Wenn in der Zelle aber ungebundene DNA mit losen Enden herumschwirrt, baut ein anderes, genaueres System (HDR, homology-directed repair) sie nahtlos an der geschnittenen Stelle ein und erzeugt so gezielte Veränderungen im Erbgut.
Welche ethischen Probleme gibt es?
Fachleute diskutieren schon seit geraumer Zeit über die grundsätzlichen ethischen Probleme bei genetischen Veränderungen an Menschen. Bisher allerdings war die Debatte rein hypothetisch - die Verfahren waren zu plump und ungenau, als dass man sich ernsthaft an solche Experimente hätte wagen können. Das Gene Editing jedoch verspricht im Prinzip beliebige, hochpräzise Änderungen am Genom. Bereits 2015 allerdings gab es Berichte über chinesische Arbeitsgruppen, die versuchten, menschliche Embryonen mit Hilfe des CRISPR/Cas9-Verfahrens von erblichen Krankheiten zu befreien. Solche einzelnen, schädlichen Gene zu reparieren, ist derzeit die naheliegendste Anwendung beim Menschen: Niemand kann doch etwas dagegen haben, Krankheiten zu heilen.
Oder doch? Kritiker fürchten, dass solche Verfahren die Definition eines genetischen Defekts immer weiter verschieben, bis alle Genvarianten außer den allergünstigsten als fehlerhaft und korrekturbedürftig gelten. Das maßgeschneiderte Designerbaby, Gegenstand vieler mehr oder weniger hilfreicher Erwägungen zur Ethik der Keimbahnveränderung, käme so im Gewand der Heilung daher.
Das dringendste Problem sind aber gar nicht die potenziellen Folgen vermeintlich maßgeschneiderter "Designerbabys" - sondern zuerst einmal, welche praktischen Konsequenzen solche Versuche angesichts des extrem lückenhaften Wissens über die tatsächlichen genetischen Zusammenhänge haben werden. Die Jagd nach dem Designerbaby wäre auf Jahrzehnte hinaus verbrauchende Forschung - aber ob das jemanden abhält, ist mindestens unklar. Möglicherweise werden solche Experimente schlicht untersagt, vergleichbar mit den 2015 gestoppten Gain-of-Function-Experimenten an gefährlichen Viren.
Die Eliminierung von Erbkrankheiten dagegen steht bereits auf der Agenda. In manchen Fällen muss hier lediglich ein einziges Gen, vielleicht ein einziges Allel korrigiert werden - wohl schon bald machbar. Die meisten Fachleute halten diese Option für ethisch vertretbar. Allerdings besteht sogar hier das Risiko, dass der Eingriff unvorhersehbare Spätfolgen haben könnte, wenn zum Beispiel das korrigierte Gen weitervererbt wird und in den Nachkommen oder auch Generationen später Konsequenzen hat, die niemand vorausgeahnt hat.
Schon heute revolutionieren CRISPR/Cas9 und verwandte Methoden alle Gebiete, in denen gentechnische Veränderungen eine Rolle spielen. Gene Editing ist einfacher und präziser als alles bisher da Gewesene, so dass bisherige Regeln nicht mehr gelten. Dabei muss klar sein, was überhaupt als genetisch verändert gilt: Ist ein Organismus mit einem an einer einzigen Stelle durch CRISPR/Cas9 veränderten Gen überhaupt gentechnisch verändert? Oder hat er nicht vielmehr bloß eine neue Variante seiner natürlichen Genausstattung? Ist ein Schwein ohne seine endogenen Retroviren genauso Schwein wie alle anderen Schweine?
Interessant wird es, wenn solche Organismen auf der Schwelle zwischen "natürlich" und "künstlich" als Produkte in die Supermarktregale kommen. Spätestens dann nämlich wird die eigentlich technische Frage nach der Definition von Gentechnik emotional. Viele Menschen möchten nichts "gentechnisch Verändertes" auf ihrem Teller - um das umzusetzen, muss man allerdings veränderte Organismen identifizieren können, selbst wenn sich die veränderten Gene nicht von natürlichen Varianten unterscheiden und so auch in unveränderte Organismen eingekreuzt werden. Gerade bei Nutztieren wäre eine solche Transparenz mit dem heutigen System kaum möglich.
Die Cas-Proteine können jede beliebige DNA zerschneiden, sofern man ihnen die passende Erkennungs-RNA mitgibt. Anschließend verlässt man sich auf die natürlichen Reparaturmechanismen der Zelle.
Im Zentrum ethischer Erwägungen steht auch bei CRISPR/Cas9 die Abwägung zwischen angestrebtem Nutzen und Risiko - zum Beispiel der Gefahr, dass unerwünschte Stellen des Erbguts verändert werden. Möglicherweise sind auch Ökosysteme bedroht, wenn genetisch veränderte Moskitos oder landwirtschaftliche Produkte in die freie Wildbahn entlassen werden. Wie hoch das Risiko ist, dass genetisches Material auf andere Arten überspringt, ist im Detail noch ungeklärt. Andererseits ist aber auch kaum abzusehen, welche negativen Folgen ein Verzicht hätte, zum Beispiel auf eine mögliche Heilung gegen Krankheiten. Bei allem Unbehagen gegenüber einer so mächtigen Technik: Ethisch gesehen scheint Fundamentalopposition kaum weniger problematisch.
Wo sind die Grenzen von CRISPR/Cas9?
Nach seiner biologischen Herkunft ist CRISPR/Cas9 ein Instrument der Zerstörung - ein gezielt erzeugter Doppelstrangbruch ist ein recht drastischer Eingriff ins Erbgut und oft nicht ohne bleibende Schäden zu reparieren. Das macht man sich zu Nutze, wenn man die so genannten Indels erzeugt, um ein Gen außer Gefecht zu setzen: fehlende oder zusätzliche Basenpaare, die den Erbgutabschnitt unlesbar machen. Unglücklicherweise entstehen Indels aber teilweise auch, wenn man zusätzliche DNA über das HDR-Reparatursystem einbaut.
Für eine hochpräzise genetische Veränderung wie bei einer Gentherapie sind die Doppelstrangbrüche des ursprünglichen CRISPR-Systems deswegen ein grundsätzliches Problem, das man zu eliminieren sucht. Neue, mutierte CRISPR/Cas9-Varianten schneiden zum Beispiel nur einen Einzelstrang, was die oft unerwünschten Indels deutlich reduziert. Zwei dieser so genannten Nickasen, die beide Einzelstränge an versetzten Stellen schneiden und so DNA-Enden mit komplementären Überhängen erzeugen, verbessen die Genauigkeit der genetischen Veränderung noch einmal deutlich.
Allerdings kann man so genannte Off-target-Mutationen, also vom CRISPR/Cas9-System ausgelöste Veränderungen an anderen Stellen des Erbguts, nie komplett ausschließen. Das Schneide-Enzym funktioniert auch dann noch, wenn die Erkennungs-RNA an bis zu fünf Stellen von der DNA-Sequenz abweicht - solche Fehler sind außerdem im Nachhinein extrem schwer zu finden. Der gegenteilige Effekt kann bei vermeintlich ausgeschalteten Genen auftreten: Die gewünschte Mutation wurde zwar eingebaut, aber das Gen wird trotzdem noch korrekt ausgelesen.
Daneben gibt es weitere Hindernisse für CRISPR/Cas9 in seiner gegenwärtigen Form. Die Technik kann zwar ausgezeichnet an einem definierten Ort des Genoms schneiden. Dazu muss aber eine bestimmte, nicht frei wählbare Gensequenz in der Nähe sein. In den meisten Genomen ist das der Fall, aber eben nicht in allen (und natürlich nie in dem, an dem man gerade arbeitet). Außerdem ist die Maschinerie für CRISPR/Cas sehr voluminös und deswegen nur schwer später als in den frühesten Embryonalstadien in Säugerzellen zu transportieren: Das Cas-Gen und die Erkennungs-RNA sind für gängige Gen-Fähren, also Viren, die das Erbgut in eine Zielzelle transportieren, schlicht zu groß. Man muss die RNA direkt einspritzen, was den Nutzen einschränkt.
Einer der wichtigsten Parameter für einen Genom-Editor ist seine Effektivität: welcher Anteil der Zielgenome im gewünschten Sinn verändert wird. Keine der heute verwendeten Genscheren erfüllt ihre Mission garantiert - tatsächlich ist die Wahrscheinlichkeit sogar in einigen besonders begehrten Anwendungen vergleichsweise gering. CRISPR/Cas9 ist am eigentlichen Gene Editing, also der gezielten Veränderung des Genoms, nicht beteiligt; das passiert mehr oder weniger zufällig. In induzierten pluripotenten Stammzellen des Menschen zum Beispiel beträgt die Effizienz von CRISPR/Cas9 etwa zwei bis fünf Prozent. In anderen Systemen wie Zebrabärbling-Embryonen dagegen ist die Wahrscheinlichkeit einer erfolgreichen Mutation schon mal höher als 70 Prozent - aber Gentherapien gegen Fisch-Erbkrankheiten sind vermutlich kein besonders großer Markt.
Welche Anwendungen sind für CRISPR/Cas9 absehbar?
In der biotechnischen Forschung hat CRISPR/Cas9 inzwischen seinen festen Platz als Gentechnik-Werkzeug gefunden, auch jenseits seiner ursprünglichen Form. Unter anderem regulieren seine Abkömmlinge im Labor gezielt Genaktivität. Dazu verwendet man ein inaktiviertes Cas9, das sich lediglich fest an spezifische DNA-Stücke anheftet. Bindet so ein Protein an eine Aktivator-Domäne, erhöht sie zum Beispiel die Aktivität des zugehörigen Gens. Wenn es dagegen die Gensequenz selbst blockiert, kann der entsprechende Sektor des Erbguts schlicht nicht mehr in RNA übersetzt werden. Mit Hilfe verschiedener, an inaktive Cas9-Systeme gebundener Proteine kann man inzwischen auch epigenetische Effekte erforschen, zum Beispiel indem man durch Fluoreszenz die räumliche Lage bestimmter Sequenzen markiert. Durch gebundene Enzyme, die Methyl- oder Azylgruppen abspalten oder anfügen, können solche CRISPR/Cas9-Systeme auch die Epigenetik in Zellen gezielt verändern.
Vor allem aber produziert man mit CRISPR/Cas9 heute sehr effektiv genetisch veränderte Organismen: Lebewesen, bei denen dank einer Mutation ein bestimmtes Gen verändert, eingefügt oder unbrauchbar gemacht wird. Solche Verfahren sind weit älter als CRISPR. So erhielten bereits 2007 die Erfinder des so genannten Gen-Knockouts den Nobelpreis für Physiologie oder Medizin. Doch CRISPR/Cas9 ist schneller, billiger und auch vielseitiger als die älteren Verfahren. Im Labor kann man auch eines der zentralen Probleme von CRISPR umgehen: die Größe der nötigen RNA. Inzwischen gibt es zum Beispiel diverse Mäuserassen, die das Cas9-Protein im eigenen Erbgut tragen - sobald ein bestimmtes molekulares Signal samt passender Erkennungs-RNA in die Zelle gelangt, steht das Molekül Gewehr bei Fuß, um das Erbgut zu verändern.
Die ersten veränderten Organismen für praktische Anwendungen jenseits der Grundlagenforschung sind ebenfalls bereits in Arbeit. Auf diese Weise wird man, wenn es nach den Plänen der beteiligten Forscherinnen und Forscher geht, in Zukunft bessere Tiermodelle für menschliche Krankheiten herstellen, ebenso wie Nutztiere und -pflanzen mit bestimmten Eigenschaften, zum Beispiel Anopheles-Mücken, die gegen Malaria resistent sind. Ein interessantes Beispiel ist eine Genombereinigung einer Arbeitsgruppe, die das Erbgut eines Schweins von den potenziell gefährlichen Retroviren befreite - eine wichtige Voraussetzung für den Plan, in Tieren menschliche Spenderorgane zu züchten.
Außerdem ist aus CRISPR/Cas9 der so genannte Gene Drive hervorgegangen - ein Mechanismus, mit dem sich bestimmte künstliche Eigenschaften schnell in Wildtierpopulationen verbreiten. Interessant ist das zum Beispiel für die Bekämpfung von Moskitos in Regionen, in denen sie gefährliche Krankheiten übertragen. Ebenfalls im Blickfeld der medizinischen Forschung sind CRISPR/Cas9-basierte Instrumente gegen Viren und Bakterien - mit Hilfe des Gene Editings soll die DNA dieser Erreger gezielt an für sie spezifischen Orten geschnitten werden. Allerdings ist noch völlig unklar, wie man die nötige RNA bei einer realen Erkrankung an den gewünschten Ort bringt.
Welche Alternativen gibt es zur CRISPR/Cas9-Technik?
Eins ist sicher: Trotz des Anfang 2017 gefällten Urteils im Patentstreit zwischen Emmanuelle Charpentier und Jennifer Doudna auf der einen Seite und Feng Zhang auf der anderen hat der Kampf um die Gewinne aus der CRISPR/Cas9-Methode gerade erst begonnen. Wegen des enormen Potenzials des Verfahrens geht es um Lizenzgebühren in Milliardenhöhe. Oder, wenn es ganz dick kommt, eben auch nicht. Während sich die University of California in Stellung bringt, doch noch nach zumindest einem Teil des Kuchens zu greifen, forschen andere Arbeitsgruppen schon längst an möglichen Alternativen.
Denn auch CRISPR/Cas9 hat Nachteile und Grenzen. Die wichtigste: Eigentlich eignet sich die Genschere nur zum Schneiden. Möchte man neues Erbgut einbauen, muss man sich dabei auf die Zelle verlassen. Die aber ist oft nur mäßig hilfreich, in vielen Fällen ist das Gene Editing nicht effektiv genug, um wie gewünscht gleich mehrere Gene auf einmal zu verändern. Zusätzlich schneidet CRISPR/Cas9 nicht an allen Stellen des Erbguts.
Deswegen sind die ins Hintertreffen gekommenen Vorläufer von CRISPR/Cas9 nicht aus dem Rennen: Sowohl TALEN und Zinkfingernukleasen - zwei ältere Klassen maßgeschneiderter Genscheren - kommen in der gentechnischen Praxis noch zum Einsatz. Diese Verfahren sind deutlich komplizierter. Wenn allerdings neben den Nachteilen von CRISPR/Cas9 noch jahrelang Unsicherheit über Lizenzgebühren besteht, könnte sich die Fachwelt wieder von CRISPR/Cas9 abwenden, zumindest für Forschung mit potenziellen kommerziellen Anwendungen.
Zusätzlich geht auch die Forschung an Alternativen weiter. Im Frühjahr 2016 veröffentlichte eine chinesische Arbeitsgruppe Ergebnisse, laut denen ein Protein namens NgAgo das Gleiche leistet - und mehr. Doch diese Ergebnisse erwiesen sich als voreilig, ebenso wie die Begeisterung über ein Protein namens lambda Red, das echtes Gene Editing ermöglichen soll - und an dem CRISPR-Pionier Zhang seit nunmehr 14 Jahren ohne großen Erfolg forscht.

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.