Lexikon der Biologie: Mitochondrien
Mitochondrien [von *mitochondr- ], Organellen der Eucyten, in denen Citratzyklus, Atmungskette (Elektronentransport) und oxidative Phosphorylierung (Atmungskettenphosphorylierung, mitochondrialer Kopplungsfaktor) verlaufen. Die Summe dieser Funktionen wird als mitochondriale Atmung, die Mitochondrien auch als die „Kraftwerke“ der Eukaryoten-Zelle bezeichnet. Nur wenige ursprüngliche Eukaryoten, z.B. die Archaezoa, besitzen keine Mitochondrien oder stattdessen Hydrogenosomen (Evolution der Eucyte). Neben den genannten Reaktionswegen verlaufen in Mitochondrien weitere Reaktionen, z.B. die Beta-Oxidation von Fettsäuren, oder Teile von Reaktionswegen, z.B. des Harnstoffzyklus. Anfang der 1950er Jahre klärten vor allem A. Claude und G.E. Palade mit Hilfe des Elektronenmikroskops die Feinstruktur der Mitochondrien auf. Die Dimensionen der meist länglich geformten Mitochondrien entsprechen etwa denen von Prokaryoten (2–8 μm ×0,2–1 μm). Zum Grundbauplan aller Mitochondrien ( vgl. Infobox und vgl. Abb. 1 ) gehören 2 Hüllmembranen, der zwischen diesen Membranen liegende nichtplasmatische Raum und das von der inneren Membran eingeschlossene Mitoplasma (Matrix). Die innere Membran wird durch Invaginationen in die Matrix hinein stark vergrößert. Diese Cristae ( vgl. Abb. 2 ) können flächig, tubulusförmig oder unregelmäßig sein. Je nach Größe und Energiebedarf der Eucyten kann die Mitochondrienzahl sehr verschieden sein: Ratten-Leberzellen ( vgl. Abb. 3 ) z.B. enthalten über 1000 Mitochondrien. Bei manchen Oocyten (Eizelle) finden sich mehr als 100.000 Mitochondrien, während viele Protozoen (wie z.B. die parasitischen Trypanosomen; Trypanosomidae) nur ein einziges, wenn auch sehr großes Mitochondrion enthalten. Für die jeweilige Zellspezies ist die Zahl der Mitochondrien (Chondriom) jedoch verhältnismäßig konstant. Auch die Ausbildung der Cristae hängt vom jeweiligen Aktivitätszustand der Zelle ab.
Mitochondrien-DNA: Wie die Plastiden werden auch die Mitochondrien als semiautonome Organelle bezeichnet, da sie ein eigenes, ringförmig angeordnetes Genom (mt-DNA;mitochondriale DNA; vgl. Abb. 4 ) besitzen, dessen begrenzte Codierungskapazität für ein autonomes Eigenleben bei weitem nicht ausreicht. Seinen Ausgang nahm die mitochondriale Genetik mit der Entdeckung der petite-Mutanten bei der Hefe Saccharomyces cerevisiae (Backhefe) durch B. Ephrussi (1949). Er entdeckte, daß bei der Plattierung von Hefe 1–2% der heranwachsenden Kolonien wegen ihres langsameren Wachstums sehr viel kleiner blieben („petite“) als die übrigen. Sie erwiesen sich als atmungsdefekt, und Kreuzungen zwischen normalen (Wildtyp) und petite-Stämmen verliefen nach einem nicht mendelnden Mechanismus (extrachromosomale oder cytoplasmatische Vererbung). In DNA-Doppelhelices interkalierende (Interkalation) Acridin-Farbstoffe (z.B. Acriflavin; Acridonalkaloide) erhöhten die Mutationsrate noch erheblich. Erst Anfang der 60er Jahre wurde dann tatsächlich DNA in Mitochondrien nachgewiesen. Heute sind bereits viele mt-DNAs sequenziert (Sequenzierung) und deren Gene kartiert (Genkartierung). Die mt-DNA ist doppelsträngig, in der Regel zirkulär (ringförmige DNA) und liegt als supercoil vor. Jedes Mitochondrion besitzt mehrere bis viele in ihrem Informationsgehalt identische DNA-Moleküle (Zellen und die aus ihnen bestehenden Individuen sind in der Regel homoplasmatisch); pro Hefezelle sind etwa 50–100 mt-DNA-Moleküle vorhanden, während z.B. in Kultur gehaltene menschliche Zellen bis 8000 solcher DNA-Ringe enthalten können. Es hat sich gezeigt, daß der Informationsgehalt (Information) der mt-DNA unabhängig von ihrer apparenten Größe (Hefe-mt-DNA: 25 μm Konturlänge ![]()
84.000 Basenpaare [bp], Tetrahymena [Hymenostomata]: 15 μm ![]()
47.000 bp, Mensch: 5 μm ![]()
16.569 bp) überall ähnlich ist (etwa 1 Gen pro 0,5–2 kbp) und die mt-DNA nur für maximal 5% der mitochondrialen Proteine codiert. Die mt-DNA Höherer Pflanzen weicht von der üblichen Organisation teilweise erheblich ab, sie ist deutlich größer und hat einen geringeren Informationsgehalt (1 Gen pro 6,3 kbp bei Arabidopsis thaliana [Acker-Schmalwand]). In einer besonderen Form liegt die mt-DNA der Trypanosomiden vor: In dem einzigen, auch als Kinetoplast bezeichneten Mitochondrion pro Zelle befinden sich Tausende von ineinandergreifenden sog. Miniringen und wenige Maxiringe. Anhand dieser Kinetoplasten-DNA wurde das RNA-Editing entdeckt. Zu weiteren Details und Besonderheiten der mt-DNA: Chondrom (Kleindruck). – Wie das genetische System der Plastiden (Chloroplasten) weicht auch das der Mitochondrien stark vom nucleoplasmatischen der Eukaryoten ab und weist viele Bezüge zum prokaryotischen auf: Histon-freie (Histone) zirkuläre DNA, die an der inneren Organellenmembran verankert ist, Fehlen von Capping-Strukturen (Capping) am 5'-Ende der mRNAs, Mitoribosomen vom prokaryotischen 70S-Typ. Diese Befunde können durch die Endosymbiontenhypothese zwanglos erklärt werden, die besagt, daß die Mitochondrien (wie auch die Plastiden) von ehemals freilebenden Prokaryoten abstammen (Evolution der Eucyte). Auch Replikation und Transkription der mt-DNA sowie die mRNA-Prozessierung und Translation weisen einige Besonderheiten auf. Die Replikation der mt-DNA beginnt in einem etwa 500 Nucleotide großen Bereich, in dem die mt-DNA oft als Drei-Strang-Struktur vorliegt, weil hier die Stränge der mt-DNA durch ein kurzes DNA-Stück auseinandergedrängt sind. Deshalb wird diese Struktur auch als Verdrängungsschleife oder displacement loop(D-loop) bezeichnet und das kurze DNA-Stück, das zu dem L-Strang der mt-DNA-Stränge komplementär ist (man benennt die beiden Stränge der mt-DNA nach ihrer Auftriebsdichte im Cäsiumchlorid-Gradienten [Dichtegradienten-Zentrifugation] als H-Strang – von engl. „heavy“ – und L-Strang – von engl. „light“), als D-loop-DNA. An der D-loop-DNA beginnt die Replikation des H-Strangs, die solange fortschreitet, bis ca. 2/3 des neuen H-Strangs synthetisiert sind. Dann erst wird durch Verdrängung des parentalen H-Strangs die Replikationsstartstelle für den L-Strang zugänglich. Nach Vollendung der Replikation beider Stränge werden durch eine Topoisomerase II (DNA-Topoisomerasen) superhelikale Windungen eingeführt. Transkription findet an beiden Strängen der mt-DNA statt, wobei vor allem Transkripte gebildet werden, die der kompletten Sequenz je eines der beiden mt-DNA-Stränge entsprechen. Diese langen Transkripte werden jedoch noch während der Transkription durch RNasen (Ribonucleasen) in die einzelnen tRNAs, rRNAs und mRNAs zerschnitten (mitochondriale RNA). Der mitochondriale Translationsapparat kommt mit einer minimalen Anzahl an tRNAs aus. Während die meisten Zellen mehr als 50 tRNAs bilden und selbst bei vollständigem Ausnutzen von Wobblepaarungen (Wobble) im genetischen Code noch 32 tRNAs nötig wären, enthalten viele Mitochondrien nur 22 tRNAs. Diese Reduzierung der tRNA-Anzahl ist möglich, weil einerseits viele Mitochondrien einige Abweichungen vom genetischen Code aufweisen, so daß weniger tRNAs benötigt werden, und andererseits die tRNAs der Mitochondrien eine besondere Struktur besitzen, die eine höhere Flexibilität der Codon-Anticodon-Paarung erlaubt. – Die mt-DNA weist eine sehr viel höhere Mutationsfrequenz auf als nucleäre DNA und ist empfindlich gegenüber freien Radikalen, Cancerogenen (cancerogen), Benzpyrenen und Aflatoxinen. Die erhöhte Empfindlichkeit führt man auf fehlende Histone, den hohen turn over und auf die besonders fehlerhaft replizierende Polymerase γ (DNA-Polymerasen) zurück. Die Mitochondrien besitzen zwar ein enzymatisches System zur DNA-Reparatur wie die meisten Pro- und Eukaryoten, aber ein wirkungsvolles Reparatursystem, das über Rekombinationsvorgänge abläuft, spielt bei ihnen eine untergeordnete Rolle. Defekte im mitochondrialen Genom haben vor allem Auswirkungen auf die Energieversorgung der Zelle. Im Lauf des Lebens angesammelte Veränderungen der mt-DNA sind mitverantwortlich für verschiedene Alternserscheinungen und Alterskrankheiten (Altern). Vererbte Defekte der mt-DNA können schwerwiegende Krankheitsbilder zur Folge haben (mitochondriale Erbkrankheiten). Mutationen in der mt-DNA bei Pflanzen sind außerdem die Ursache für die cytoplasmatisch vererbte männliche Sterilität (Abk. CMS;male sterility).
Genese: Die Vermehrung der Mitochondrien geschieht durch Zweiteilung ( vgl. Abb. 5 ), indem etwa in der Mitte des Organells ein Septum eingezogen wird. Wegen der bereits erwähnten geringen Codierungskapazität der mt-DNA müssen die meisten Mitochondrienproteine aus dem Cytoplasma importiert werden. Diese Proteine, die an freien 80S-Ribosomen des Cytoplasmas entstehen, werden als längerkettige Präkursoren (Prä-Proteine) synthetisiert. Sie tragen am Aminoterminus eine zusätzliche, 15–60 Aminosäuren lange Transit-Sequenz, die sog. Mitochondrien-Eintrittsequenz, die solche Proteine als mitochondriale Proteine kennzeichnet und ihre Ankopplung an einen in der äußeren Mitochondrienmembran lokalisierten Rezeptor ermöglicht. Der Import erfolgt über einen Transportapparat an Kontaktstellen der inneren und äußeren Mitochondrienmembran (Proteintransport). In der Matrix wird die Mitochondrien-Eintrittsequenz durch die Matrix-Protease abgespalten (vektorielle Prozessierung). Im Intermembranraum oder in der inneren Membran lokalisierte Proteine enthalten eine weitere Signalsequenz, die ihren Weitertransport von der Mitochondrien-Matrix zu ihrem Zielort ermöglicht. Bei Proteinen der äußeren Membran vermittelt die Mitochondrien-Eintrittsequenz lediglich den Kontakt zu dieser Membran, aufgrund einer hydrophoben Stop-Transfer-Sequenz verbleiben sie in der äußeren Membran. Adenylattranslokator, Aminoacyl-tRNA-Synthetasen, Apoptose, Biochemie (Geschichte der), Kompartimentierung, Malat-Aspartat-shuttle, Membran, Membrantransport; Zelle.
B.L./J.S./M.B.
Lit.: Alberts, B., Bray, D., Lewis, J., Raff, M., Roberts, K., Watson, J.D.: Molekularbiologie der Zelle. Weinheim 31995. Douce, R.: Mitochondria in higher plants. Orlando 1985. Kleinig, H., Maier, U.: Zellbiologie. Stuttgart 41999. Ude, J., Koch, M.: Die Zelle. Atlas der Ultrastruktur. Jena 21994.
Mitochondrien
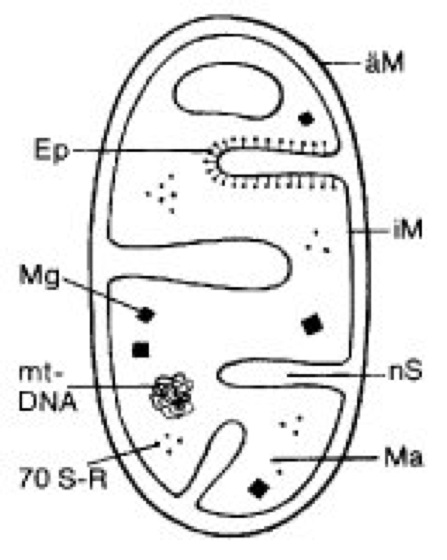
Abb. 1: Schematischer Querschnitt eines Mitochondriums mit den wesentlichen Strukturen. äM äußere Membran (Monoaminoxidase, NADH-Cytochrom-c-Reductase, Cholesterin), Ep Elementarpartikel (ATP-Synthase), iM innere Membran (Succinat-Dehydrogenase, Cytochromoxidase, Cardiolipin), Ma Matrix (Citratzyklus), Mg Matrixgranula (Ca2+, Mg2+), mt-DNA mitochondriale DNA, nS nichtplasmatischer Spalt, 70 S-R 70S-Ribosomen
Mitochondrien
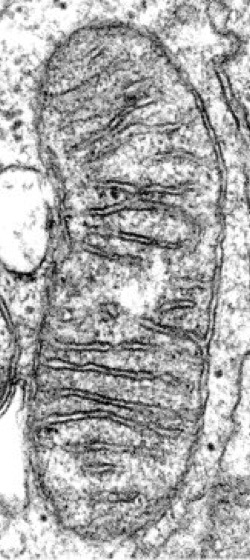
Abb. 2: Mitochondrion in einem Lymphocyten. Die Cristae sind hier flächig und in der elektronenmikroskopischen Aufnahme im Querschnitt getroffen.
Mitochondrien
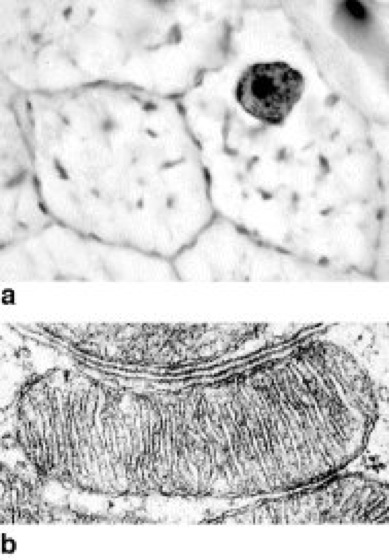
Abb. 3: a Lichtmikroskopische Aufnahme zweier Leberzellen in Eisen-Hämatoxylin-Färbung; die Mitochondrien sind als stark angefärbte granuläre oder fadenförmige Strukturen zu erkennen. b elektronenmikroskopische Aufnahme eines Mitochondrions aus einer Leberzelle
Mitochondrien
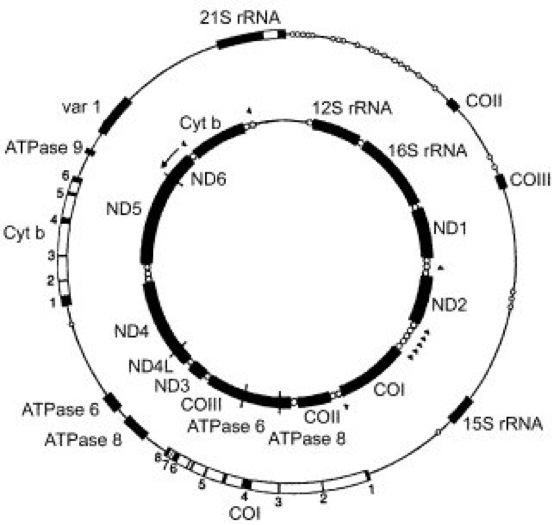
Abb. 4: Zusammensetzung der mitochondrialen Genome der Hefe (äußerer Kreis) und des Menschen (innerer Kreis). Auf diesen Genkarten sind Gene für Proteine und rRNAs schwarz, Intronen als helle Bereiche und tRNA-Gene (nur für menschliche mt-DNA) als Kreise eingezeichnet. Nicht-codierende Bereiche sind als einfache Linien dargestellt. Stellen, an denen die Transkriptionsrichtung entgegen dem Uhrzeigersinn verläuft, sind durch Pfeile markiert – COI–III: Untereinheiten der Cytochromoxidase; ATPase 6, 8 und 9: Untereinheiten des ATP-Synthase-Komplexes; ND1-6 und 4L: Untereinheiten der NADH-Dehydrogenase; Cyt b: Apocytochrom b; var 1: Protein der kleinen ribosomalen Untereinheit. Auf der mt-DNA der Hefe liegen die Gene COI und Cyt als Mosaikgene vor, die Exonen sind von 1–6 bzw. 1–8 durchnumeriert. Die kompakte Genanordnung auf der mt-DNA des Menschen erlaubt keine Intronen.

Mitochondrien
Abb. 5: Schema der Mitochondrienteilung
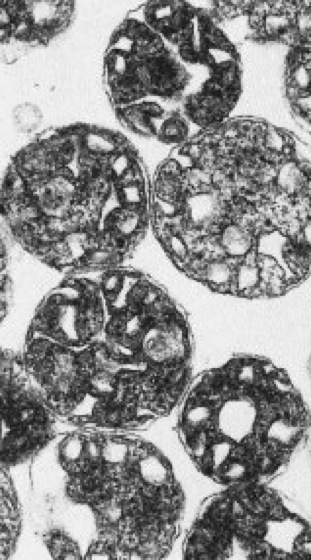
Mitochondrien
Abb. 6: Mitochondrien lassen sich in gepufferten, isotonischen Medien aus einem Gewebehomogenat isolieren und stehen dann im sog. in vitro-System für die Bearbeitung vieler Fragestellungen zur Verfügung. So können z.B. die mitochondriale Atmung (d.h. der Sauerstoffverbrauch) oder Transportphänomene an solchen isolierten Organellen untersucht werden. Die elektronenmikroskopische Aufnahme zeigt eine Mitochondrienfraktion aus einem pflanzlichen Gewebe.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.