Lexikon der Biologie: Paramyxoviren
Paramyxoviren [von *para- , griech. myxa = Schleim], Paramyxoviridae, Familie von human- und tierpathogenen RNA-Viren, die in die beiden Unterfamilien Paramyxovirinae (mit den Gattungen Morbillivirus, Respirovirus und Rubulavirus) und Pneumovirinae (mit den Gattungen Pneumovirus und Metapneumovirus) unterteilt wird ( vgl. Tab. 1 ). Paramyxoviren besitzen ein lineares, nicht segmentiertes, einzelsträngiges RNA-Genom mit Minusstrang-Polarität und bilden deshalb zusammen mit den Rhabdoviren, Filoviren und Bornaviren (Bornavirus) die Ordnung Mononegavirales. Zu den Paramyxoviren gehören bedeutende Krankheitserreger (Infektionskrankheiten) von Tier und Mensch. Beim Menschen ( vgl. Tab. 2 ) sind es die Erreger von Masern und Mumps, Parainfluenzaviren und Respiratory-syncytial-Virus als Erreger von respiratorischen Erkrankungen sowie das erst kürzlich entdeckte Hendra-Virus und Nipah-Virus. Das Newcastle-disease-Virus ist der Erreger der atypischen Geflügelpest (Newcastle-disease). Die vom Rinderpest-Virus hervorgerufene Rinderpest tritt heutzutage nur noch in Afrika, dem Nahen Osten und Asien auf, hat aber in Europa in früheren Jahrhunderten durch ausgedehnte Seuchenzüge zu schweren Hungersnöten geführt. – Die Viruspartikel haben eine pleomorphe, meist runde (Durchmesser 150–250 nm), manchmal fadenförmige Gestalt ( vgl. Abb. 1 ). Sie sind aus einem inneren Nucleocapsid und einer äußeren Lipoprotein-Hülle aufgebaut. Die Hülle besteht aus Membranlipiden der Wirtszelle und 2 oder 3 virusspezifischen Proteinen, die stachelartige Fortsätze (Länge 8–12 nm) bilden. Die Anheftung der Viruspartikel an die Wirtszellen erfolgt über die Glykoproteine HN (Hämagglutinin-Neuraminidase), H (Hämagglutinin) oder G (Glykoprotein). Im Falle von HN und H bewirkt die starke Bindung an N-Acetylneuraminsäure-haltige Rezeptoren die Agglutination von Erythrocyten (Hämagglutination). Viren der Gattungen Rubulavirus und Respirovirus besitzen HN-Glykoproteine, Viren der Gattung Morbillivirus fehlt meist die Neuraminidase-Aktivität, während dem G-Protein der Pneumoviren sowohl Neuraminidase- als auch meist Hämagglutinin-Aktivität fehlt. Das Glykoprotein F bewirkt die Fusion von Virushülle und Zellmembran. Es wird als inaktives Vorläuferprotein (F0) synthetisiert, das durch eine zelluläre Protease in die aus 2 Untereinheiten F1 und F2 bestehende aktive Form gespalten werden muß. Das F-Protein ist außerdem verantwortlich für die Lyse von Erythrocyten (Hämolyse) sowie für die Fusion von Zellen, welche die Bildung von Syncytien (mehrkernigen Riesenzellen) in infizierten Wirtsgeweben (z.B. bei einer Masernvirus-Infektion) und in Zellkulturen zur Folge hat. Die Fähigkeit von Paramyxoviren (vor allem des Sendai-Virus) zur Zellfusionierung wurde für die Herstellung von Zellhybriden zur genetischen Analyse somatischer Zellen verwendet. Einige Rubulaviren und Mitglieder der Pneumovirinae enthalten ein kleines zusätzliches Membranprotein SH, dessen Funktion noch nicht bekannt ist. Die Innenseite der Hülle wird von dem nicht-glykosylierten Membran- oder Matrixprotein M ausgekleidet, das bei der Morphogenese der Virionen eine wesentliche Rolle spielt. Im Nucleocapsid (mit helikaler Symmetrie, Durchmesser 12–18 nm) liegt das RNA-Genom (Länge 15–16 kb) in einem Komplex mit den Proteinen N (oder NP), P und L vor. Das N-Protein (N = Nucleocapsid) ist die Hauptkomponente des Nucleocapsids; es schützt die RNA vor Abbau durch Nucleasen, verleiht ihr die nötige Flexibilität zur Verpackung und wird zur Initiation von Transkription und Replikation benötigt. L (L = large protein) und P (P = Phosphoprotein) bilden zusammen die virale RNA-abhängige RNA-Polymerase (RNA-Replikase). Beim Sendai-Virus enthält jedes Nucleocapsid 2600 N-, 300 P- und 50 L-Proteine. Die Anordnung der Gene auf dem Genom ( vgl. Tab. 3 ; Anzahl meist 6, bei einigen Rubulaviren 7, bei Pneumoviren 8) ist bei den verschiedenen Paramyxoviren ähnlich. An Anfang und Ende eines jeden Gens liegen konservierte Kontrollsequenzen, zwischen den Genen kurze intergenische Sequenzen. Die Genomenden werden von kurzen nichtcodierenden Sequenzen gebildet (3'-leader und 5'-trailer). – Bei einer Paramyxovirus-Infektion (Virusinfektion) erfolgt nach Virusanheftung und Fusion der Virushülle mit der zellulären Plasmamembran die Freisetzung des Nucleocapsids ins Cytoplasma, in dem alle weiteren Schritte der Virusreplikation ablaufen. Dabei dient das helikale Nucleocapsid, und nicht die freie Genom-RNA, als Matrize zur Synthese von mRNA (Transkription) und Antigenom-RNA (Replikation). Da Paramyxoviren ein Minusstrang-RNA-Genom besitzen, wird zunächst durch die im Virion enthaltene RNA-Polymerase die mRNA-Synthese durchgeführt. Die Transkription beginnt am äußersten 3'-Ende des Genoms mit einer kurzen nicht-codierenden "leader"-RNA, bevor die subgenomischen mRNAs für die einzelnen Protein-codierenden Gene durch Wiederstart und Stop an den konservierten terminalen Sequenzen gebildet werden ( vgl. Abb. 2 ). Die Lage eines Gens im Genom bestimmt die Effizienz seiner Transkription, wobei mit wachsender Entfernung vom 3'-Ende die Transkriptionsrate sinkt. Bei den Paramyxovirinae wird die Codierungskapazität durch RNA-Editing, überlappende ORFs (offenes Leseraster) und unterschiedliche Translationsstartstellen im P-Gen erhöht. An einer Editierungsstelle werden bei der mRNA-Synthese zusätzliche G-Reste (1 oder 2) eingebaut, so daß mRNAs mit unterschiedlichen offenen Leserastern entstehen, die in die verschiedenen P-Genprodukte translatiert werden. Nachdem virale Transkripte und Proteine (vor allem N-Protein) in ausreichenden Mengen synthetisiert worden sind, schaltet die Polymerase von der mRNA- auf die Antigenom-Synthese um. Dabei werden alle internen Stopsignale überlesen, so daß eine exakte Kopie der Genom-RNA hergestellt werden kann. Das Antigenom dient dann als Matrize zur Synthese neuer Minusstrang-Genom-RNAs. Bei der Virion-Morphogenese entstehen die Nucleocapside durch Zusammenlagerung von Genom-RNA mit N-Proteinen und Assoziation mit dem P-L-Komplex. Nach Verankerung der viralen Glykoproteine in der Plasmamembran werden die Nucleocapside durch budding, bei dem das M-Protein eine wesentliche Rolle spielt, mit der Hülle ummantelt und die reifen Viruspartikel freigesetzt. – Die meisten Paramyxoviren können persistierende Infektionen in Zellkulturen oder im Wirtsorganismus hervorrufen. Als seltene Spätfolge einer akuten Masernvirusinfektion (nach durchschnittlich 6–8 Jahren) kann bei Kindern und Jugendlichen eine tödlich verlaufende degenerative Erkrankung des Gehirns (subakute sklerosierende Panencephalitis, Abk. SSPE) auftreten. Paramyxoviren besitzen 3 verschiedene Antigene (HN- oder H-, F-Protein und NP-Nucleoprotein), gegen die bei einer Infektion Antikörper gebildet werden. Im Vergleich zu Influenzaviren (mit segmentiertem Genom, Antigendrift und Antigenshift) ist die Antigenvariabilität von Paramyxoviren äußerst gering. Bei Masern- und Mumpsvirus ist jeweils nur ein einziger Antigentyp vorhanden, so daß eine Infektion oder Immunisierung eine lebenslängliche Immunität hinterläßt. Bei Parainfluenzaviren können Reinfektionen auch in Gegenwart von Antikörpern auftreten. Myxoviren, Viren, Virusinfektion, Viruskrankheiten; Viren.
E.S.
Paramyxoviren
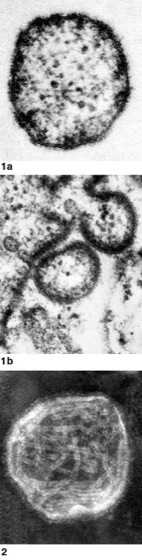
Abb. 1:
Elektronenmikroskopische Aufnahmen von Paramyxoviren.
1Masernvirus:a Viruspartikel, b Knospung von Masernviren an der Zellmembran. 2 Viruspartikel des Mumpsvirus; im Innern sind die fädigen Strukturen des helikalen Nucleocapsids, am äußeren Rand die Glykoprotein-Spikes der Virushülle zu erkennen.

Paramyxoviren
Abb. 2: Bei der Genexpression werden subgenomische Transkripte hergestellt, deren Mengen in Transkriptionsrichtung kontinuierlich abnehmen.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.