Lexikon der Neurowissenschaft: Plastizität im Nervensystem
Essay
Josef P. Kapfhammer
Plastizität im Nervensystem
Neuronale Plastizität (Neuroplastizität; Eneuronal plasticity) bezeichnet die Veränderbarkeit neuronaler Verbindungen im Nervensystem. Das Konzept neuronaler Plastizität steht damit für die Erkenntnis, daß die neuronalen Verbindungen nicht starr und invariabel sind, sondern aufgrund bestimmter funktioneller Geschehen (z.B. bei Lernprozessen; Lernen) oder nach Verlust von Nervenzellen oder Axonen Veränderungen unterliegen können. Das Netzwerk neuronaler Verbindungen unterscheidet sich damit grundsätzlich von der Verschaltung eines elektronischen Computerchips, die unveränderbar festliegt. Aus obiger Definition ergibt sich, daß unter dem Begriff der neuronalen Plastizität eine größere Zahl verschiedener Sachverhalte und Mechanismen zusammengefaßt werden. Eine mögliche und häufig vorgenommene Einteilung der plastischen Vorgänge im Nervensystem ist diejenige in funktionelle und strukturelle Plastizität.
Funktionelle Plastizität
Bei der funktionellen Plastizität verändert sich insbesondere die Effizienz der synaptischen Übertragung. Dadurch ist es möglich, die funktionelle Verschaltung eines Netzwerks zu verändern, ohne daß dazu eine Veränderung in der anatomischen Verbindungsstruktur nötig wäre. Die Effizienz synaptischer Übertragung ist auf zwei Arten regulierbar. Zum einen kann ein Aktionspotential in der präsynaptischen Endigung einer Nervenzelle zu einer vermehrten Transmitterausschüttung führen, was eine verstärkte Aktivierung der postsynaptischen Zelle zur Folge hat. Man spricht hier von einem präsynaptischen Mechanismus. Zum anderen können in der postsynaptischen Membran vermehrt Transmitterrezeptoren eingebaut werden. Dann führt die Ausschüttung derselben Transmittermenge ebenfalls zu einer vermehrten Aktivierung der postsynaptischen Zelle. In diesem Fall spricht man von einem postsynaptischen Mechanismus. Es gibt für beide Mechanismen gute experimentelle Hinweise, so daß vermutlich beide zur funktionellen Plastizität beitragen. Für Lernvorgänge ist die funktionelle Plastizität von besonderer Bedeutung, da auf diese Art die synaptische Übertragung in mehreren, gleichzeitig aktiven Synapsen verstärkt wird. Nach der Hebb-Lernregel wird die synaptische Übertragung dann effizienter, wenn die betreffende Synapse aktiv und gleichzeitig die postsynaptische Zelle depolarisiert ist. Dies ist immer dann der Fall, wenn mehrere Synapsen gleichzeitig eine Zelle erregen. Für die Auslösung dieser Verstärkung spielt an vielen Synapsen die Aktivität des NMDA-Rezeptors (Glutamatrezeptoren) eine Rolle, der erst bei einer Depolarisation der Zelle aktiviert wird und über einen vermehrten Ca2+-Ionen-Einstrom (Calcium) langfristige Veränderungen der synaptischen Effizienz auslösen kann. Das klassische experimentelle Beispiel für die funktionelle Plastizität ist die sogenannte Langzeitpotenzierung (LTP). Hierbei wird ein Fasertrakt wiederholt stimuliert, was zu einer starken, gleichzeitigen Aktivierung vieler Synapsen führt. Wird die synaptische Effizienz einzelner Synapsen in diesem Fasertrakt später untersucht, so zeigt sich eine deutliche Potenzierung der postsynaptischen Antwort auf eine gleiche präsynaptische Stimulation. Dieser Effekt bleibt über mehrere Tage erhalten und kann somit einem Lernvorgang gleichgesetzt werden.
Strukturelle Plastizität
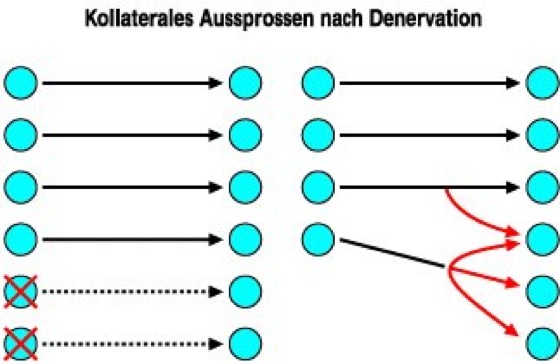
Strukturelle oder anatomische Plastizität unterscheidet sich in ihren Mechanismen möglicherweise nicht grundsätzlich von der funktionellen Plastizität. Das hauptsächliche Unterscheidungskriterium besteht darin, daß es hier zu anatomisch faßbaren Veränderungen im neuronalen Netzwerk kommt. Dabei ist zu beachten, daß die Empfindlichkeit neuroanatomischer Methoden, mit der solche Veränderungen detektiert werden können, recht gering ist. Es ist somit prinzipiell denkbar, daß wir es im Grunde mit einem Kontinuum an Veränderungen zu tun haben, die zunächst nur die molekulare Ausstattung von Prä- und Postsynapse betreffen, dann aber auch zu Veränderungen etwa der Struktur dendritischer Dornen führen kann, und schließlich mit der Bildung neuer Synapsen (terminales Aussprossen) oder gar neuer Axone (kollaterales Aussprossen) einhergeht. Neue Ergebnisse zeigen, daß es auch bei der Langzeitpotenzierung, die ein typisches Beispiel für funktionelle Plastizität darstellt, möglicherweise zu morphologischen Veränderungen im Bereich der dendritischen Dornen kommen kann. Ursprünglich waren anatomisch faßbare Veränderungen nur nach massiven Eingriffen in das neuronale Netzwerk, d.h. nach Läsionsexperimenten, beobachtet worden. Es wurde nun gezeigt, daß nach partieller Denervation eines Zielgebietes, d.h. dem physischen Verlust von Nervenfasern oder Nervenzellen, die intakt gebliebenen, überlebenden Axone neue Kollateralen bilden und die denervierten Neurone reinnervieren können. Dabei wird häufig wieder eine weitgehend normale Synapsendichte in dem denervierten Gebiet erzielt ( siehe Abb. 1 ).
Das Auftreten solcher kompensatorischen Wachstumsphänomene ist in einer großen Zahl verschiedener Versuchsmodelle experimentell nachgewiesen worden. Es kann durch Läsionen auch im erwachsenen Nervensystem ausgelöst werden. Gut untersuchte Beispiele sind das kollaterale Aussprossen hippocampaler kommissuraler Fasern nach Läsionen des entorhinalen Cortex oder das Aussprossen von Rückenmarksafferenzen nach Wurzelläsionen. Auch nach Verletzungen der Pyramidenbahn können unverletzte Fasern im jungen Gehirn Kollateralen bilden, die auf die Gegenseite des Rückenmarks wachsen und dort die Zielbereiche der ausgefallenen Pyramidenbahn reinnervieren ( siehe Abb. 2 ). Für alle aufgeführten Beispiele gilt, daß das Ausmaß dieser Wachstums- und Reorganisationsvorgänge im jungen, noch unreifen Gehirn wesentlich stärker ausgeprägt ist als im späteren Leben. Das funktionelle Ergebnis einer Regeneration nach Hirnschädigungen bei Säuglingen oder Kleinkindern ist meist besser als bei Erwachsenen (Kennard-Prinzip). Dies stimmt auch mit der Beobachtung überein, daß das junge, unreife Gehirn ein hohes Maß an Veränderbarkeit aufgrund verschiedener sensorischer Erfahrungen zeigt. Das klassische Beispiel hierfür sind Veränderungen im visuellen Cortex nach monokulärer visueller Deprivation. Unter diesen Bedingungen (die z.B. beim Menschen bei starker einseitiger Fehlsichtigkeit oder angeborenem Katarakt auftreten können), verliert das deprivierte Auge einen erheblichen Teil seiner visuellen Projektion ins Gehirn. Dieser Verlust an Axonterminalen ist anatomisch nachweisbar und kann während der sogenannten kritischen Periode innerhalb weniger Tage auftreten ( siehe Zusatzinfo ). Nach erfolgter Reifung des Gehirns reicht eine sensorische Deprivation in der Regel nicht aus, anatomisch faßbare Veränderungen zu induzieren. Erst nach Denervation kann das Aussprossen und Auswachsen von Nervenfasern auch im erwachsenen Gehirn nachgewiesen werden.
Ein wichtiger Unterschied zwischen dem erwachsenen und dem unreifen Gehirn besteht in der Bildung der Myelinscheiden um die Axone. Während im unreifen Gehirn kaum Myelin vorhanden ist, sind im erwachsenen Gehirn die Faserzüge, aber auch das Neuropil der grauen Substanz überwiegend stark myelinisiert. Das Myelin des Zentralnervensystems enthält jedoch Hemmstoffe des Nervenfaserwachstums, die als Nogo bezeichnet werden. Diese Wachstumsunterdrückung wurde in verschiedenen experimentellen Systemen zunächst für das regenerative Nervenfaserwachstum im Gehirn, später auch für kollaterales Aussprossen nachgewiesen. Das Myelin des Zentralnervensystems mit den Nogo-Hemmstoffen des Nervenfaserwachstums kann somit als ein stabilisierendes Element für vorhandene Faserverbindungen angesehen werden.
Plastizität, Parallelverarbeitung und Reorganisation
Eine Reihe weiterer Mechanismen stehen mit neuronaler Plastizität in Verbindung. So ist für eine Vielzahl von funktionellen Systemen des Gehirns bekannt, daß sie parallele Verarbeitungswege benutzen. Es ist unmittelbar einsichtig, daß der Ausfall eines einzelnen dieser parallel angeordneten Verarbeitungswege nicht zum Zusammenbruch des gesamten Systems führen muß, sondern daß unter günstigen Bedingungen die verbleibenden Wege den Verlust einer Komponente kompensieren können und der völlige Funktionsausfall vermieden werden kann. Solche Verlagerungen in der Aktivität einzelner Hirnregionen können heute mit Methoden sehr gut nachgewiesen werden, die den regionalen Blutfluß oder den regionalen Sauerstoffverbrauch des Gehirns bestimmen. Hierbei kommen insbesondere die Positronenemissionstomographie und die funktionelle Magnetresonanztomographie zum Einsatz. Mit beiden Methoden konnte nach verschiedenen Schädigungen des Gehirns eine erhebliche Reorganisation der Aktivitätsmuster für bestimmte Tätigkeiten und Aufgaben nachgewiesen werden. So wurde etwa bei Patienten mit Alzheimer-Krankheit bei Gedächtnistests eine Aktivierung von Hirngebieten nachgewiesen, die bei Gesunden nicht mit dieser Aufgabe korreliert sind. Auch bei Hirntumoren, die einzelne Hirnregionen zerstören, konnte eine Verlagerung der Aktivitätsmuster auf benachbarte Hirnregionen nachgewiesen werden; dasselbe gilt für die Reorganisation des Gehirns nach Schlaganfällen oder nach Amputationen (Phantomglied, Willkürmotorik, Zusatzinfo 3). Bei solchen eher globalen Verlagerungen der Gehirnaktivität spielen natürlich neben dem Vorhandensein eines parallelen Verarbeitungsweges auch wieder die oben beschriebenen Mechanismen eine Rolle.
Plastizität im Nervensystem
Abb. 1: Kollaterales Aussprossen: Bei Denervation von Nervenzellen können die Axone der verbleibenden benachbarten Zellen neue Kollateralen bilden (rote Pfeile), welche die denervierten Zielzellen reinnervieren.
Plastizität im Nervensystem
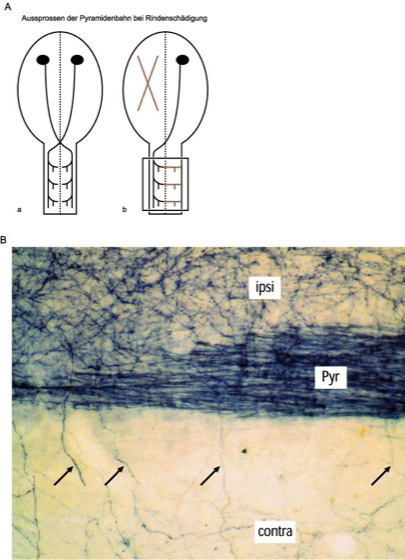
Abb. 2: Aussprossende Axone der Pyramidenbahn.
ASchematische Darstellung
a intaktes Zentralnervensystem mit Pyramidenbahnen
b Nach einer Verletzung des Rückenmarks oder einer Schädigung der Hirnrinde kann es zum Ausfall einer Pyramidenbahn kommen. Da jede Pyramidenbahn normalerweise eine Hälfte des Rückenmarks innerviert, kommt es zur Denervation dieser Rückenmarksseite. Im jungen Zentralnervensystem können nun die Fasern der verbliebenen Pyramidenbahn neue Kollateralen bilden, welche über die Mittellinie wachsen und die denervierten Gebiete wieder innervieren (Kasten).
BHistologische Darstellung
Hier wurden nach einer Läsion der Pyramidenbahn einer Seite die Fasern der verbliebenen Pyramidenbahn mit einem Tracer markiert (Pyr, dunkle Markierung). Einige Fasern, die normalerweise nur die ipsilaterale Seite des Rückenmarks (ipsi) innervieren, bilden neue Kollateralen (Pfeile), die im rechten Winkel abgehen, über die Mittellinie hinweg wachsen und die denervierte Seite (contra) re-innervieren.
Plastizität im Nervensystem
Plastizität und Deprivation:
Mit elektrophysiologischen Einzelzell-Ableitungen und Autoradiographie ließ sich zeigen, daß die visuellen Reize in Regionen verarbeitet werden, die über die primäre Sehrinde streifenförmig verteilt sind und ihre Informationen jeweils aus dem einen oder dem anderen Auge erhalten, die Augendominanzsäulen. Ausgangspunkt ihrer Ausbildung sind zufällige Schwankungen in der Anzahl der Innervationen corticaler Neurone durch vorgeschaltete Nervenfasern. Vorangetrieben wird die Entwicklung durch die Koordination gleichzeitig feuernder Fasern, die durch die Stimulation desselben Auges erregt werden, im Wettbewerb mit Eingängen aus den beiden Augen. So erfolgt eine selbstorganisierte gleichmäßige, nicht-überlappende Raumaufteilung. Mit Computersimulationen läßt sich dies in vielen Einzelheiten nachvollziehen. Störungen können während dieser sensiblen, kritischen Phase irreparable Schäden verursachen. Wird beispielsweise ein Auge verschlossen, ist es später nicht oder nur noch eingeschränkt funktionstüchtig. Es zeigte sich auch, daß die Projektionsflächen des intakten Auges in der primären Sehrinde sich auf Kosten der Reiz-deprivierten Felder ausgedehnt haben. Spezifische Deprivationen hinterlassen während dieser Periode ebenfalls irreversible Spuren: Werden Kätzchen beispielsweise in einem Raum gehalten, dessen Wänden ausschließlich mit senkrechten Streifen bemalt sind, werden sie später keine waagrechten Streifen mehr wahrnehmen können. Die als entsprechende Merkmalsdetektoren fungierenden Neuronen sind nicht oder kaum noch erregbar durch die Reize, für die sie bei einer normalen Entwicklung sensibel gewesen wären.
Nicht nur die Einschränkung von Sinnesreizen, sondern auch Übung beeinflußt das Gehirn. Ratten, die in einer komplexen Umwelt gehalten werden, haben im Vergleich zu Kontrolltieren in einer reizarmen Umgebung eine höhere Synapsendichte. Sowohl die Zahl der Synapsen pro Neuron als auch der Verzweigungsgrad der Dendriten und die Anzahl der Vesikel in der Präsynapse sind größer. Ähnliche Ergebnisse sind im Vorderhirn nach Verhaltenstraining und in bestimmten Kleinhirnregionen nach motorischem Training gefunden worden.
R.V.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.