Lexikon der Biologie: Cytochrome
Cytochrome [von *cyto –, griech. chrōma = Farbe], Zytochrome, Gruppe von Chromoproteinen, die aufgrund der farbgebenden Komponente, der eisenhaltigen Häm-Gruppe (Häm), neben den verwandten Hämoglobinen und Myoglobinen eine Untergruppe der Hämoproteine bildet. Cytochrome sind gekennzeichnet durch den reversiblen Valenzwechsel des Häm-Eisenatoms (Eisen) vom zweiwertigen zum dreiwertigen Zustand, wobei ein Elektron freigesetzt (bzw. bei der Umkehrreaktion gebunden) wird: Fe2+![]()
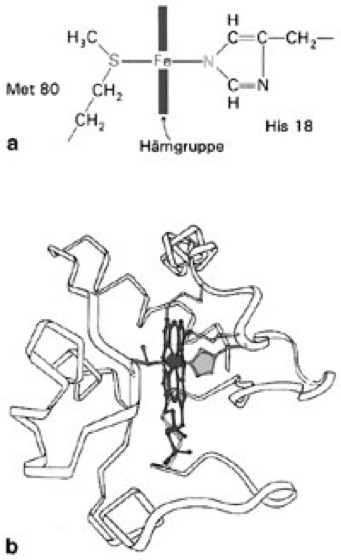
Fe3+ + e–. Darauf beruht die Funktion der Cytochrome als Elektronendonatoren sowie -akzeptoren beim Elektronentransport in der Atmungskette, bei der Photosynthese und einigen anaeroben bakteriellen Vorgängen. Die einzelnen Cytochrome unterscheiden sich durch die Seitengruppen des Eisen-Porphyringerüsts ( vgl. Abb. ), durch die Art der chemischen Bindung (kovalent oder nicht-kovalent) des Eisenporphyringerüsts (Porphyrine) an die Proteinkette, durch die Aminosäuresequenz der Proteinketten und ihre Absorptionsspektren. Nach diesen Kriterien werden sie in die 3 Hauptgruppen a, b und c eingeteilt, deren einzelne Vertreter durch Hinzufügen von Indizes (einfache Numerierung oder Absorptionsmaximum) gekennzeichnet werden. Aufgrund ihrer zentralen Funktion als Elektronenüberträger in der Atmungskette und Photosynthese kommen Cytochrome in allen Tieren, Pflanzen, allen aeroben und den meisten anaeroben Mikroorganismen vor. Bei den Cytochromen gibt es sowohl wasserlösliche Formen (Cytochrom c, Cytochrom c6) als auch Cytochrome, die membranassoziiert oder als Teile integraler Membranproteine vorliegen. Alle 3 Formen der Cytochrome kommen in der Atmungskette vor, die Reihenfolge der Elektronenübertragung wird durch die Redoxpotentiale der einzelnen Cytochrome (sowie der anderen Redoxkomponenten der Atmungskette) bestimmt (Atmungskette, Abb.1. und 2). – An dem dem Sauerstoff zugewandten Ende der Atmungskette steht der Cytochrom-aa3-Komplex, der neben Cytochrom a und Cytochrom a3 Kupfer-Ionen (Kupfer) als Cofaktoren enthält. Der Cytochrom-aa3-Komplex, der identisch mit der Cytochromoxidase (früher auch Warburgsches Atmungsferment genannt) ist, überträgt Elektronen von löslichem Cytochrom c auf molekularen Sauerstoff. – Das dimere Cytochrom b enthält wie Hämoglobin das Eisen(II-)Protoporphyrin IX als prosthetische Gruppe. Es besitzt das niedrigste Redoxpotential der Atmungskette und liegt zwischen Ubichinon und Cytochrom c. Es ist sehr fest an die Mitochondrienmembran gebunden (Ablösung nur durch Detergentien). Das zentrale Eisenatom von Cytochrom b ist wie das von Cytochrom c nicht autoxidabel und reagiert nicht mit Kohlenmonoxid oder Cyanid. Das oligomere Cytochrom b5 im endoplasmatischen Reticulum der Vogel- und Säugetierleber überträgt vermutlich Elektronen auf das Fettsäure-Oxygenase-System. Seine Hämgruppe ist nichtkovalent über Histidin an das Apoprotein gebunden und reagiert nicht mit O2. Das lösliche und myoglobinähnliche Cytochrom b562 von Escherichia coli besitzt das höchste Redoxpotential aller bekannten Cytochrom-b-Typen. Die oligomeren Cytochrome b6 und b559 aus den Chloroplastengranula (Chloroplasten) Höherer Pflanzen sind Bestandteil der photosynthetischen Elektronentransportkette. Cytochrom b1 aus Escherichia coli und Cytochrom b2 aus Hefe sind Tetramere mit Dehydrogenaseaktivität. Gleichfalls zum Cytochrom-b-Komplex gehört das Cytochrom P450 (Cytochrom-P450-System), das in Mitochondrien und im endoplasmatischen Reticulum von Säugern als Coenzym mischfunktioneller Oxygenasen (Hydroxylasen) wirkt und damit besonders für Hydroxylierungsreaktionen von Steroiden verantwortlich ist. – Cytochrom c ist das häufigste und zugleich am besten untersuchte Cytochrom (bei Wirbeltieren 104 Aminosäuren, relative Molekülmasse 12 400; bei Höheren Pflanzen 111 Aminosäuren, relative Molekülmasse 13 100). Es ist zentraler Bestandteil der Atmungskette aller Eukaryoten, seine Hämgruppe ist an das Apoprotein über 2 Thioetherbindungen zu Cysteinresten (Cystein) im Innern des Moleküls gebunden. Das Eisenatom ist mit 2 weiteren "verborgenen" Resten, dem Methionin 80 und Histidin 18, verbunden ( vgl. Abb. ), wodurch erreicht wird, daß das Eisen des nativen Cytochroms c weder mit Sauerstoff noch mit anderen hämkomplexierenden Agenzien, z. B. Kohlenmonoxid, reagiert. Charakteristisch für Cytochrom c aus Höheren Pflanzen bzw. Wirbeltieren ist, daß es am aminoterminalen Ende keine freie Aminogruppe, sondern N-Acetylalanin bzw. N-Acetylglycin aufweist. Bemerkenswert sind außerdem die bisher bei keinem anderen globulären Protein beobachteten starken Konformationsunterschiede zwischen der Eisen(II-)Form (kompakte Struktur) und Eisen(III-)Form (lockere, öltropfenähnliche Gestalt) des Cytochroms c. Eukaryoten besitzen zusätzlich das mitochondriale Cytochrom c1, das unlöslich ist und eine größere relative Molekülmasse als Cytochrom c aufweist. Bakterielles Cytochrom c (z. B. Cytochrom c2–c5, Cytochrom c551 und Cytochrom c553) hat Ähnlichkeit mit eukaryotischem Cytochrom c, reagiert jedoch nicht mit der Säugetier-Cytochromoxidase. Cytochrom c555, auch Cytochrom c6 oder (meistens) Cytochrom f genannt, findet sich in den Chloroplastenmembranen von Geißeltierchen (Euglena) und in Höheren Pflanzen, wo es mit Cytochrom b559 beim Elektronentransport in der Photosynthese mitwirkt. Cytochrom f aus Spinat besteht aus 8 Untereinheiten, von denen nur 4 eine Hämgruppe haben. Cytochrom f ist außerdem Bestandteil der Sulfidreductasen aus grünen Schwefelbakterien. – Die zahlreichen Cytochrome von chemolithotrophen Bakterien (Chemolithotrophie) sind als Glieder von entsprechenden Elektronentransportketten an der Oxidation einfacher anorganischer Stoffe, wie H2, NH3, NO2–, Fe2+, CO, H2S, S, bzw. an der Übertragung von Elektronen auf Nitrat als Oxidationsmittel (statt auf O2) beteiligt. – Phylogenetisch gehören die Cytochrome zu den ältesten Proteinen, deren Aminosäuresequenzen sowie Konformationen sich in den letzten 2 Milliarden Jahren teilweise nur noch wenig abgewandelt haben. Daher wurden besonders die aus knapp über 100 Aminosäuren aufgebauten Proteinketten des Cytochroms c zur Analyse des Verwandtschaftsgrades vieler Spezies – auch von Bakterien – aufgrund Übereinstimmung bzw. Abweichung der jeweiligen Aminosäuresequenzen verwendet ( vgl. Tab. ; evolutionäre Uhr, Sequenzhomologie, Sequenzstammbaum). Die Unterschiede verteilen sich größtenteils auf 2 Teilsequenzen, von Aminosäure 17 bis 32 und 67 bis 80 (konstante Region). Cytochrom-c-Sequenzen von Ente und Huhn unterscheiden sich nur in 2 Aminosäurepositionen, während diejenigen von Pferd und Hefe in 48 Positionen differieren. Der mit Hilfe des Vergleichs von Cytochrom-c-Sequenzen aufgebaute Stammbaum steht in Einklang mit auf andere Weise erschlossenen Phylogenien (ribosomale RNA). Der Vergleich der Cytochrom-c-Sequenzen erlaubt die Bestimmung von variablen und sequenzkonstanten Bereichen der Cytochrome. Enzyme, Membranproteine, Metalloproteine, Ubichinone, Warburg (O.H.); Dissimilation I
Dissimilation II
H.K./J.I./M.B.
Lit.:Omura, T., Ishimura, Y., Fujil-Kuriyama, Y. (Hrsg.): Cytochrome P 450. Weinheim 21993. Schenkman, J.B., Greim, H. (ed.): Handbook of Experimental Pharmacology. Vol. 105: Cytochrome P450. Berlin 1993.
| |
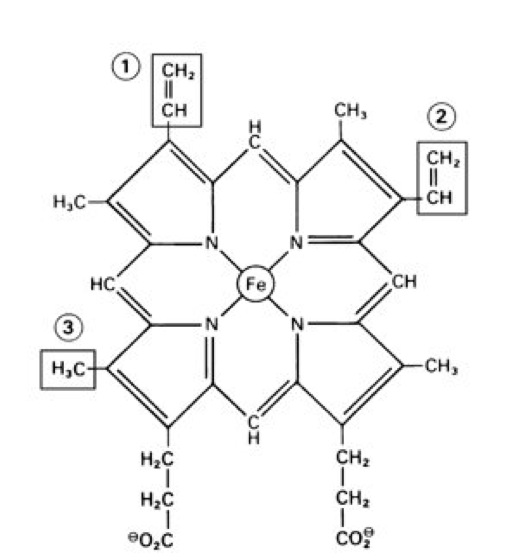
Cytochrome Struktur der Häm-Coenzyme in den Cytochromen. Die Formel entspricht dem Häm der Cytochrome bk und bT (Atmungskette) (und ebenso dem des Hämoglobins und Myoglobins). Im Falle der Cytochrome c1 und c ist an die Doppelbindungen oben im Molekül (bei 1 und 2) je eine Cystein-Seitenkette des Proteins direkt "addiert", das Häm-Coenzym ist hier mit dem Protein kovalent verbunden. Bei den Cytochromen a und a3 trägt die Position 1 einen hydrophoben Isoprenrest mit 15 C-Atomen, links ist in Position 3 die CH3-Gruppe durch CHO ersetzt. |
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.