Lexikon der Biologie: freie Radikale
freie Radikale, anorganische oder organische Verbindungen, die ein oder mehrere (durch einen Punkt symbolisierte) ungepaarte (einsame) Elektronen besitzen (chemische Bindung), oft sehr reaktionsfähig sind und als solche häufig nur kurzfristig existieren. Sie entstehen z.B. bei der Spaltung kovalenter Bindungen, wenn jeweils ein Elektron des gemeinsamen Elektronenpaares bei den Spaltstücken verbleibt (homolytische Fission). Von besonderer biologischer Bedeutung sind Sauerstoffradikale, wie das Hydroxylradikal (OH•) und das Sauerstoffanion- oder Superoxidradikal (O2•–). Intrazelluläres, nicht proteingebundenes Eisen und Kupfer spielen ebenfalls eine wichtige Rolle bei der Radikalbildung (s.u.). Auch der Singulett-Sauerstoff (1O2) wird als hoch reaktives Molekül („aktivierte Sauerstoffspezies“) in diesem Zusammenhang genannt, obwohl er nach der obigen Definition nicht zu den freien Radikalen gehört, da er keine ungepaarten Elektronen besitzt. – Freie Radikale können in einer großen Anzahl verschiedener Reaktionen sowohl exogen als auch endogen produziert werden. Mit jedem Zug an einer Zigarette (Rauchen) werden etwa 1014 freie Radikale aufgenommen! Schwefeldioxid – selbst kein freies Radikal – kann über die Bildung des Sulfit-Ions (SO32–; Sulfite) und anschließende Reaktion mit dem Sauerstoffradikal O2•– selbst Radikale bilden (SO3•–, SO4•–, SO5•–), was für die Beurteilung der Luftschadstoffbelastung (Luftverschmutzung) relevant ist. Stickstoffmonoxid (NO) und Stickstoffdioxid (NO2) sind weitere Vorläufer freier Radikale (Stickoxide). Hydroxylradikale werden aus Wasserstoffperoxid, Peroxyradikalen, über enzymatische Reaktionen (Oxidoreductasen, Xanthin-Oxidase, NADPH-Oxidase) und bei der Elektronenübertragung von Flavinen und Chinonen gebildet. Derartige Reaktionen laufen besonders im Zusammenhang mit phagocytotischen Vorgängen (Phagocytose) in Verbindung mit Entzündungen, hämolytischen Prozessen (Hämolyse) und bei der Photosynthese ab. Das OH•-Radikal gehört zu den reaktionsfreudigsten chemischen Stoffen. Es geht mit organischen Molekülen Reaktionsketten ein, in denen jede Reaktion neben einem Reaktionsprodukt ein neues freies Radikal bildet. Durch Antioxidantien kann die Reaktionskette unterbrochen werden. Ausgelöst wird die Bildung von OH•-Radikalen durch Reaktionen von Metallionen mit Wasserstoffperoxid (Fenton-Reaktion;vgl. Abb. 1 ), durch ionisierende Strahlen oder durch Einwirkung von Ozon. Ein geringer Teil des körpereigenen Eisens ist nicht proteingebunden (Eisenstoffwechsel), sondern liegt als Chelatkomplex mit ATP, GTP und Citrat vor. Dieser Anteil kann auch unter in-vivo-Bedingungen Eisen in die Fenton-Reaktion einbringen und ist daher als potentieller Produzent von freien Radikalen zu berücksichtigen. Es ist wahrscheinlich, daß die biochemische Ursache für pathologische Erscheinungen im Zusammenhang mit einer überhöhten Eisenzufuhr (z.B. Herzerkrankungen) in einer dadurch ausgelösten Hydroxylradikalbildung zu suchen ist. Möglicherweise führt auch ein Überschuß von freiem Kupfer im Körper, wie er z.B. bei der Wilsonschen Krankheit durch einen Mangel an dem Kupfer bindenden Protein Coeruloplasmin gegeben ist (Apoptose), zur Bildung von freien Radikalen. Eine Mischung von Cu+ und H2O2 wirkt über die Bildung von OH·-Radikalen proteinzerstörend. Die wichtigsten Quellen für die Bildung des Superoxidradikals sind die Atmungskette in den Mitochondrien und das endoplasmatische Reticulum. Bei Pflanzen kommt die Elektronentransportkette der Chloroplasten hinzu. Sowohl in den Mitochondrien als auch in den Chloroplasten basiert die Bildung des O2•– darauf, daß die Elektronentransportketten nicht absolut präzise funktionieren, sondern etwas „leck“ sind. Dadurch können einzelne Elektronen auf Sauerstoff übertragen werden. In der Atmungskette liegt die „undichte Stelle“ hauptsächlich am NADH-Coenzym-Q-Reductase-Komplex und bei der reduzierten Form des Coenzyms Q (Ubichinone). In den Chloroplasten sind es die Elektronenakzeptoren des Photosystems I und das Ferredoxin im Stroma. Am endoplasmatischen Reticulum entstehen die Anionenradikale bei den Monooxygenase- (mischfunktionelle-Oxidase-) Reaktionen (Hydroxylasen), die eine große Anzahl von Xenobiotika umsetzen und (meist) entgiften (Entgiftung). An den Reaktionen sind Cytochrom P450 (Cytochrom-P450-System) und das Flavoprotein NADPH-Cytochrom-P450-Reductase beteiligt. In der Membran, die den Zellkern umgibt (Kernhülle), existiert ein – bisher kaum charakterisiertes – Elektronentransportsystem, das in Gegenwart von NADH (Nicotinamidadenindinucleotid) oder NADPH (Nicotinamidadenindinucleotidphosphat) und mit zunehmender Sauerstoffkonzentration O2•– an das umgebende Medium abgeben kann. Möglicherweise ist dies eine besonders kritische Stelle wegen der engen Nachbarschaft des Systems zur Kern-DNA. Das Reaktionsvermögen von O2•– ist in organischen Lösungen wesentlich stärker als in wäßrigen Lösungen. O2•– kann daher im hydrophoben Milieu der Membranen erhebliche Schäden anrichten (z.B. Zerstörung von Phospholipiden). In wäßrigem Milieu wirkt O2•– reduzierend und wird dabei schnell zu H2O2 dismutiert. O2•– allein ist hierbei weniger gefährlich, vielmehr ist es die Bildung von Hydroxylradikalen über die Weiterreaktion des Wasserstoffperoxids mit H2O – eine Umsetzung, die schon lange (seit 1934) als Haber-Weiss-Reaktion bekannt ist ( vgl. Abb. 1 ). In vivo läuft sie nur in Gegenwart von katalytisch wirkenden Eisenionen ab (eisenkatalysierte Haber-Weiss-Reaktion), wobei das O2•– 3wertiges Eisen reduziert, das dann in der Fenton-Reaktion weiter mit H2O2 reagiert. Über die Regeneration 2wertigen Eisens, die die Vorbedingung für den Ablauf der Fenton-Reaktion bildet, sind O2•–-Radikale auch an der Entstehung von Alkoxyradikalen aus Hydroperoxiden beteiligt. Im biologischen System gilt dies insbesondere für die Lipidperoxidation, da hierbei eine Kettenreaktion ausgelöst wird, die bis zum Untergang der betroffenen Zellen führen kann. Andererseits führt die spezifische Oxidation mehrfach ungesättigter Fettsäuren zu so essentiellen Substanzen wie Leukotrienen und Prostaglandinen. Die erwähnte Kettenreaktion wird durch die Entfernung eines Wasserstoffatoms von einer Methylengruppe (CH2–) unter Bildung eines Kohlenstoffradikals (–•CH–) eingeleitet. Benachbarte Doppelbindungen erleichtern diesen Schritt. Das Kohlenstoffradikal reagiert über ein stabileres Zwischenprodukt (ein konjugiertes Dien) weiter mit molekularem Sauerstoff zum Peroxyradikal (–R–OO•; vgl. Abb. 2 ). Dieses kann nun seinerseits ein Wasserstoffatom aus einem Lipidmolekül entfernen, wobei es selbst zum Lipid-Hydroperoxid wird. Hydroperoxide sind (unter physiologischen Bedingungen) relativ stabil, werden aber wiederum unter katalytischer Beteiligung von Metallen (die in diesem Falle aber auch proteingebunden sein können, z.B. Eisen im Hämoglobin, Myoglobin, Cytochrom) schnell zersetzt. Hierbei entstehen je nach Wertigkeit des Metalls Alkoxyradikale (R–O•) oder Peroxyradikale; letztere sind weniger reaktiv. Ein Produkt aus derartigen Reaktionsketten ist u.a. das gasförmige Pentan, das relativ einfach nachweisbar ist und daher auch analytisch für die Messung der Lipidperoxidation in vivo herangezogen wird. Neben Peroxiden können aus Peroxyradikalen auch zyklische Peroxide entstehen ( vgl. Abb. 3 ). Folgeprodukte sind zyklische Endoperoxide, wie sie auch charakteristisch für Prostaglandine sind. Sie werden durch O2, Hydrolyse oder durch Hitzeeinwirkung u.a. zu Aldehyden zersetzt, von denen Malondialdehyd wiederum analytisch wichtig zum Nachweis derartiger Prozesse ist. Im Organismus kann der Malondialdehyd durch Reaktionen mit Aminogruppen von Proteinen zur Vernetzung und Aggregation von Membranproteinen führen. Im Endeffekt werden dadurch verschiedene Enzyme inhibiert (z.B. D-Glucose-6-Phosphatase oder Na+K+-ATPasen) und Hormonrezeptoren auf der Zellmembran inaktiviert. Insgesamt spielt die Lipidperoxidation unter Beteiligung von Superoxidradikalen bei der Genese von Membranschäden aller Art eine zentrale Rolle. Bei der Bildung von Methämoglobin, der täglich etwa 3% des Hämoglobins in den menschlichen Erythrocyten anheimfallen und bei der das 2wertige Eisen nicht unter Beibehaltung seiner Wertigkeit oxygeniert, sondern zum 3wertigen Eisen oxidiert wird, werden ebenfalls Superoxidradikale gebildet. Der Erythrocyt ist daher zusammen mit den Enzymen des Pentosephosphatzyklus reich mit Superoxid-Dismutase, Katalase und Glutathion-Peroxidase (Glutathion) – alles Enzyme, die dem Schutz vor Oxidation dienen (s.u.) – ausgestattet ( vgl. Abb. 4 ). Daneben gibt es eine spezifische Methämoglobin-Reductase, die das Hämoglobin wieder regeneriert. Für Säuglinge kann das Problem verstärkt werden, wenn in der Flaschennahrung durch einen hohen Stickstoffgehalt des Wassers (infolge Überdüngung des Bodens) zuviel NO3– vorhanden ist. Darmbakterien reduzieren das NO3– (Nitrate) zu NO2- (Nitrite), das nach Resorption eine exzessive Methämoglobinbildung und dadurch Sauerstoffmangelversorgung (neben potentiellen Radikalschäden) auslöst. Im Zusammenhang mit Xanthin-Oxidase ist das Superoxidradikal schließlich an der Ausprägung der gefürchteten Reperfusionsschäden, wie sie nach Ischämien infolge von Koronarerkrankungen des Herzens oder beim Schock auftreten können, beteiligt. Das für den Elektronentransfer im Xanthin- oder Hypoxanthin-Stoffwechsel (Hypoxanthin) verantwortliche Enzym hat hauptsächlich Xanthin-Dehydrogenase-Aktivität (d.h., der Elektronenakzeptor ist NAD+) und nur zum geringen Teil Oxidase-Aktivität (unter Bildung von O2•–). Bei Sauerstoffmangelerscheinungen wird in den betroffenen Zellen viel ATP abgebaut und Hypoxanthin akkumuliert. Sauerstoffzufuhr zur Behebung der Ischämie verstärkt die Oxidase-Aktivität der Xanthin-Dehydrogenase, führt zur Oxidation des Hypoxanthins und zu verstärkter Bildung von O2•–. Allopurinol, ein Xanthin-Oxidase-Hemmstoff, wird eingesetzt, um die unerwünschten Nebenwirkungen der Reperfusion zu unterbinden. Singulettsauerstoff wird – ebenso wie echte Sauerstoffradikale – bei phagocytotischen Prozessen und weiterhin über verschiedene Reaktionen der Photosensitivierung (z.B. nach Belichtung von Flavinmononucleotiden, Flavinadenindinucleotiden, Chlorophyll a und b, Bilirubin, Retinal, Porphyrinen) gebildet. Bei dem dadurch ausgelösten photodynamischen Effekt (Photosensibilisatoren) kann der gebildete Singulettsauerstoff mit anderen Molekülen reagieren oder die photosensitivierenden Stoffe selbst zerstören (z.B. Photobleichung des Chlorophylls, Schädigung von Zellen – insbesondere Lichtsinneszellen – durch Exposition gegenüber hohen Lichtintensitäten [bleichen], Schädigung von Linsenproteinen, Katarakt, „Schlechtwerden“ der Milch oder von Milchprodukten im Licht durch Degradation von Proteinen und Lipiden in Gegenwart von Riboflavin). Eine Reihe von Krankheiten ist ebenfalls auf die Bildung von Singulettsauerstoff zurückzuführen, speziell die sog. Porphyrien (Porphyrine). Durch eine Störung im Porphyrinmetabolismus werden Porphyrine vermehrt via Exkretion ausgeschieden oder in die Haut eingelagert. Lichtexposition verursacht dann mehr oder weniger starke Degenerationen, Pusteln und Eruptionen. OH•-Radikale spielen hierbei zusätzlich eine Rolle. Die Giftigkeit verschiedener Pflanzen für Menschen und Weidevieh (z.B. Johanniskraut [Hypericum; Hartheu], Buchweizen [Fagopyrum]) beruht auf ihrem Gehalt an photosensitivierenden Substanzen (Photosensibilisatoren), die über die Bildung von Singulettsauerstoff zu verschiedenen Lichtdermatosen führen können. Gelegentlich werden photosensitivierende Reaktionen auch in der Medizin eingesetzt, z.B. beim Gebrauch von Psoralen (Furocumarine) gegen Hautkrankheiten (Psoriasis = Schuppenflechte). Reaktionen von Singulettsauerstoff mit ungesättigten kovalenten Kohlenstoffbindungen, speziell konjugierten Doppelbindungen (Konjugation), sind mitbeteiligt an der Endoperoxidbildung, wie sie für das AlterspigmentLipofuscin, aber auch beim Ranzigwerden (Autoxidation, Fette) und für die Ausbildung von Firnissen typisch ist. Aus dem bisher Gesagten geht hervor, daß die Reaktionen freier Radikale im Organismus netzartig miteinander verflochten sind. Sie sind für die Pathogenese einer Reihe von Krankheiten, für die Zerstörung von Zellmembranen und für Alterungsprozesse verantwortlich (Altern). Andererseits dienen sie aber auch dem Erhalt des Organismus und seiner adäquaten Funktionen, z.B., indem sie durch Beteiligung an der Ausbildung eines definierten Redoxpotentials in der Zelle Entwicklungs- (Entwicklung) und Differenzierungsprozesse (Differenzierung) steuern. Seneszenzprozesse (Seneszenz) bei Pflanzen, wie z.B. die Fruchtreife, sind streng kontrollierte oxidative Vorgänge, die mit der Bildung von Lipidperoxiden und H2O2 einhergehen. Die DNA-Synthese verläuft unter Beteiligung von Tyrosin-Radikalen (Tyrosin), die Teile der Untereinheit der Ribonucleosiddiphosphat-Reductase bilden. Die Synthese von Prostaglandinen sowie – unter Beteiligung einer Lipoxygenase – die von Leukotrienen, die u.a. als Mediatoren eine Rolle spielen, gehört ebenfalls zu den „positiven“ Wirkungen der Radikale. Sauerstoffradikale sind ferner von entscheidender Bedeutung bei der Induktion der Apoptose. Ein Beispiel für die Verknüpfung von Radikalreaktionen ist die Phagocytose. Neutrophile Granulocyten, Makrophagen und andere phagocytierende Zellen verbrauchen mit Beginn der Phagocytose in einer Cyanid-resistenten Atmung sprunghaft mehr Sauerstoff. Hierbei wird ein an die Plasmamembran gebundener Enzymkomplex aktiviert, der NADPH oxidiert. Die frei werdenden Elektronen reduzieren Sauerstoff zum Superoxidradikal, das weiter zu Wasserstoffperoxid dismutieren kann oder über die Eisen-katalysierte Haber-Weiss-Reaktion OH•-Radikale bildet. H2O2 und OH• zerstören Bakterienmembranen. In phagocytotischen Vakuolen wird weiterhin eine Myeloperoxidase aktiv, die in Gegenwart von Cl–-Ionen (Chlor) die Bildung von Hypochlorsäure (HOCl) katalysiert; diese reagiert weiter mit H2O2 unter Bildung von Singulettsauerstoff. Tumorpromotoren, wie Phorbolester, induzieren einen entsprechenden Anstieg der Sauerstoffaufnahme in phagocytierenden Zellen. Sie fördern des weiteren Entzündungsprozesse (Entzündung), so daß auch hier die Beteiligung von freien Radikalen deutlich wird. Andererseits können verschiedene Nahrungsbestandteile die Wirkung von Carcinogenen (cancerogen) unterdrücken, z.B. Selen und synthetische Antioxidantien. Dem Organismus stehen aber auch eine Reihe von körpereigenen Enzymen und nicht-enzymatischen Antioxidantien oder Radikalfänger zur Verfügung, mit Hilfe deren er sich direkt oder indirekt vor der schädigenden Wirkung freier Radikale schützen kann. An Enzymen sind dies Katalase und Peroxidase (Peroxidase-Reaktion), die – wie erwähnt – mit Wasserstoffperoxid reagieren. Ebenfalls mit Wasserstoffperoxid reagiert die Glutathion-Peroxidase (ein Selen-haltiges Enzym), wogegen die Glutathion-Reductase die Rückreaktion von GSSG zu GSH katalysiert und damit den Gehalt dieses wichtigsten nicht-enzymatischen Antioxidans stabilisiert (Glutathion). Für die Dismutation von Superoxidradikalen sorgen verschiedene Superoxid-Dismutasen (SOD), die nach ihren unterschiedlichen Metallanteilen benannt werden (CuZn-SOD's, Mn-SOD's, Fe-SOD's). Neben Glutathion gibt es eine ganze Anzahl endogener und exogener niedermolekularer Radikalfänger, die auch eine – mitunter umstrittene – therapeutische Funktion besitzen. Am bekanntesten sind Vitamin C (Ascorbinsäure) und Vitamin E (Tocopherol) sowie die Vitamin-A-Vorstufe β-Carotin. In neuerer Zeit ist die Verwendung von Melatonin und Dehydroepiandrosteron (DHEA) besonders in den USA stark propagiert worden, indem man diesen Hormonen über ihre antioxidativen Eigenschaften hinaus eine „verjüngende“ Funktion zuschrieb. Harnsäure ist ein weiterer körpereigener Radikalfänger. Auch Ethanol (Ethylalkohol) wirkt – in mäßigen Konzentrationen zugeführt – in diesem Sinne. In höheren Konzentrationen (Alkoholismus) trägt der Alkohol selbst zur Bildung von freien Radikalen bei, indem er partiell durch ein „mikrosomales Ethanol oxidierendes System“ oxidiert wird. Tumorzellen zeigen eine bemerkenswerte Resistenz gegenüber Lipidperoxidation, obwohl ihre enzymatischen Antioxidantien vermindert sind. Dies geht mit einer veränderten Lipidzusammensetzung der Zellen einher. Insgesamt scheint der Redoxzustand von neoplastischen Zellen –entsprechend ihrem embryonalen Erscheinungsbild – weit auf der reduzierten Seite zu liegen. Paneth (F.A.).
K.-G.C.

freie Radikale
Abb. 1

freie Radikale
Abb. 2: Start und Verlauf der Lipidperoxidation am Beispiel einer Fettsäure mit 3 konjugierten Doppelbindungen

freie Radikale
Abb. 3: Bildung von Lipid-Hydroperoxiden und zyklischen Peroxiden aus Arachidonsäure
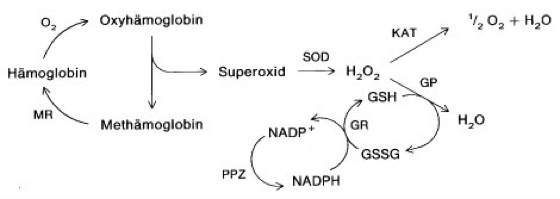
freieRadikale
Abb. 4: Schutz der Erythrocyten gegen Sauerstoffschädigungen durch die Oxidation von Hämoglobin. Etwa 3% des menschlichen Hämoglobins werden täglich oxidiert. Neben den dargestellten Schutzmechanismen existiert eine Methämoglobin-Reductase, die Fe(III)-Häm zu Fe(II)-Häm reduziert.
MR = Methämoglobin-Reductase,
SOD = Cu–Zn-Superoxid-Dismutase, KAT = Katalase,
GP = Glutathion-Peroxidase,
GR = Glutathion-Reductase,
PPZ = Pentosephosphatzyklus
(erstes Enzym: Glucose-6-phosphat-Dehydrogenase)
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.