Lexikon der Biologie: Hämoglobine
Hämoglobine [von ä *hämo- , Globin], Abk. Hb (auch für Sing. Hämoglobin), rote Blutfarbstoffe,Chromoproteine, die vorwiegend dem Sauerstofftransport dienen (Atmungspigmente, Tab.) und bei Menschen und Wirbeltieren in den Erythrocyten, bei vielen Wirbellosen (z.B. Zuckmücken, Daphnien und anderen) frei in der Hämolymphe vorkommen. Das Hämoglobin der Erythrocyten ist ein Tetramer, das aus 4 Polypeptidketten – je 2 identischen – und 4 eisenhaltigen, farbgebenden prosthetischen Hämgruppen (Häm; ä vgl. Abb. 1 ) besteht und eine relative Molekülmasse von 65.000–68.000. Die extrazellulären Hämoglobine der Wirbellosen können bis zu 250 Häm-haltige Untereinheiten und relative Molekülmassen von bis zu 4 Millionen aufweisen. In den Erythrocyten liegt Hämoglobin als 34%ige Lösung vor und transportiert den Sauerstoff (O2) von der Lunge zu den anderen Geweben bzw. das im Körpergewebe gebildete Kohlendioxid (CO2) zu den Atmungsorganen (Alveole, Blutgase). Bei einem Fe2+-Gehalt (Eisen) von 0,334% und einer Gesamtmenge von 950 g Hb im menschlichen Körper sind im Hämoglobin 3,5 g oder 80% des Gesamtkörpereisens enthalten. – Hämoglobinstruktur: Das humane Adulthämoglobin besteht aus 2 α- und 2 β-Ketten, wobei die α-Ketten 141 und die β-Ketten 146 Aminosäurereste enthalten. Die Sequenzen des Human-Hämoglobins und die vieler anderer Wirbeltier-Hämoglobine sind aufgeklärt. Die Tertiärstruktur der Hämoglobinketten und die Quartärstruktur des gesamten tetrameren Moleküls wurden mittels Röntgenstrukturanalyse bestimmt. Abgesehen von geringen Abweichungen, die sich aus den Unterschieden der Primärstruktur ergeben, sind die Hämoglobinketten ganz ähnlich wie das Myoglobin gefaltet. Man unterscheidet 8 helikale Hauptsegmente (bezeichnet mit den Buchstaben A bis H, ergänzt mit der Nummer des jeweiligen Restes, z.B. A1 als erster Rest der Helix A) mit 5 dazwischenliegenden nichthelikalen Segmenten (bezeichnet mit den Buchstaben der angrenzenden helikalen Bereiche, z.B. CD als Bereich zwischen den Helices C und D). Auch die Fixierung der Hämgruppe über ihr Eisen(II)-Atom an 2 Histidinreste – das sog. proximale Histidin besetzt direkt die 5. Koordinationsstelle des Eisens, das distale Histidin auf der anderen Seite der Hämebene dient der Stabilisierung nach Sauerstoffbindung – sowie über hydrophobe Wechselwirkungen in der Häm-Tasche entspricht der Anordnung im Myoglobin. Diese komplizierte Faltung der Polypeptidketten mit der charakteristischen Plazierung der Hämgruppe ist ein fundamentales Bauprinzip sauerstoffübertragender Moleküle. Dies ist um so mehr erstaunlich, als die Aminosäuresequenzen von Hämoglobin und Myoglobin sich sehr unterscheiden (Übereinstimmung nur in 24 der 141 Positionen). Ein Vergleich der Sequenzen der Hämoglobine von mehr als 60 verschiedenen Arten zeigt außerdem eine beträchtliche Variationsbreite in den meisten Positionen. Es gibt jedoch 9 Stellen mit unveränderten Resten, die für die Funktion des Hämoglobins von entscheidender Bedeutung sind, z.B. F8 (proximales) Histidin, E7 (distales) Histidin und CD1 Phenylalanin. Unterschiedliche Aminosäuresequenzen können also ganz ähnliche dreidimensionale Strukturen spezifizieren. Funktionell wesentlich sind die beim Myoglobin fehlenden nichtkovalenten, vorwiegend hydrophoben Wechselwirkungen zwischen den einzelnen Hämoglobinketten. Sie bilden besonders zwischen den α- und β-Ketten große hydrophobe Kontaktregionen, welche die Grundlage für die Wechselwirkungen der 4 räumlich getrennten Hämgruppen bei der reversiblen, kooperativen Bindung von 4 Sauerstoffmolekülen je Hämoglobinmolekül bilden. Die hydrophoben Wechselwirkungen ermöglichen außerdem das Aufeinandergleiten der beiden α/β-Dimere während der O2-Beladung und -Abgabe. – Konformationsänderung durch Oxygenierung: Man unterscheidet 2 Konformationen des Hämoglobins, den kompakteren R-Zustand (relaxed) des Oxyhämoglobins (Oxy-Hb) mit hoher Sauerstoffaffinität und den T-Zustand (tense) des Desoxyhämoglobins (Desoxy-Hb) mit einer bedeutend geringeren Affinität. Das Desoxy-Hb ist durch eine höhere Anzahl von Ionenbindungen zwischen den verschiedenen Untereinheiten charakterisiert. Nach spektroskopischen Untersuchungen geht die Bindung von Sauerstoff an ein Hämoglobinmolekül mit einer Elektronenübertragung unter Bildung eines Eisen(III)-O2–-Addukts einher, wobei das Superoxid-Ion durch Wasserstoffbrücken mit dem Proton des distalen Histidinrests stabilisiert wird. Eine Konformationsänderung vom T- in den R-Zustand ist die Folge der Oxygenierung ( ä vgl. Abb. 2 ). Die Struktur der einzelnen Untereinheiten ändert sich dabei wenig, aber die Anordnung der α- und β-Untereinheiten verschiebt sich. Im T-Zustand liegt das Häm-Eisenatom etwas außerhalb der Ebene des Porphyrinrings. Durch die Bindung von O2 bewegt sich das Eisenatom in die Häm-Ebene hinein, das Häm nimmt eine mehr planare Konformation ein, wobei die Position des proximalen Histidinrests (F8) und damit der ganzen F-Helix, der EF-Ecke und der FG-Ecke, verschoben wird ( ä vgl. Abb. 3 ). Dieses führt zu Verschiebungen an 2 der 4 Kontaktbereiche der Untereinheiten (nämlich dem α1β2- und dem α2β1-Kontakt), zu einer Drehung des α1β1-Paares relativ zum anderen um 15 Grad und – im Zuge dieser Veränderungen – zum Aufbrechen von Ionenbindungen zwischen diesen Untereinheiten. Die Oxygenierung einer Untereinheit wird also in Strukturänderungen an den Kontaktflächen zwischen den einzelnen Untereinheiten übersetzt und damit entfernten Molekülbereichen mitgeteilt. Dieser allosterische Effekt (Allosterie) ist für die sigmoide O2-Bindungskurve des Hb verantwortlich (Bohr-Effekt). – Sauerstofftransport: Bei hohem O2-Partialdruck (in der Lunge) wird O2 an die zweiwertigen Eisen-Atome (Fe2+) der Hämgruppen angelagert, wodurch Hb in Oxy-Hb (Hb · O2) übergeht. Bei niedrigem O2-Partialdruck (im Gewebe) gibt Oxy-Hb wieder O2 ab (Desoxy-Hb). Die Fähigkeit des Hb, im Lungengewebe O2 zu binden und CO2 freizusetzen, im übrigen Gewebe dagegen den umgekehrten Prozeß zu durchlaufen (Carbamino-Hämoglobin), erklärt sich aus einer reversiblen Verschiebung seiner O2-Affinität in Abhängigkeit von Acidität und CO2-Druck des umgebenden Gewebes. Verbunden ist dieses Phänomen mit der unterschiedlichen Affinität von Desoxy- und Oxy-Hb zu BPG ( ä vgl. Infobox ) und Protonen. Oxy-Hb bindet keine H+-Ionen, Desoxy-Hb dagegen für 4 O2-Moleküle je 2 Protonen. Während des Übergangs von Oxy-Hb zu Desoxy-Hb werden 3 Paare negativ geladener (d.h. protonenbindender) Gruppen in eine stärker negative Umgebung überführt: Die resultierenden Erhöhungen des pK-Werts dieser Gruppen machen sie für die Bindung von Protonen verfügbar. Fester als O2 bindet Hb Kohlenmonoxid (CO) zu Kohlenmonoxidhämoglobin (Hb · CO), die Affinität des Hb zum giftigen CO ist 325mal größer. Dadurch fällt bei Gegenwart von CO viel Hb für den O2-Transport aus (Ersticken durch Kohlenmonoxidvergiftung). Oxidierende Blutgifte, wie nitrose Gase, Chlorate und andere, führen das Fe2+ des Häms leicht in Fe3+ über (Eisenstoffwechsel). Häm wird so zu Hämatin (dessen Chlorid, das Hämin, als Teichmannsche Kristalle ein gutes Erkennungsmittel für Blut ist) und Hb zu Methämoglobin (Met-Hb) oder Hämiglobin, das ebenfalls kein O2 binden kann. Freies Hb, Oxy-Hb, Met-Hb und Hb · CO absorbieren Licht unterschiedlicher Wellenlänge und können daher über ihre Absorptionsspektren unterschieden werden. Auch im Organismus bietet die „Proteintasche“ für die Hämgruppen keinen hundertprozentigen Oxidationsschutz. Ein erheblicher Teil der Stoffwechselleistungen der Erythrocyten besteht darin, ständig Met-Hb wieder zu Hb zu reduzieren. – Spezifische Hämoglobine und Globin-Gene: In verschiedenen Entwicklungsstadien eines Organismus bilden sich häufig spezifische Hämoglobine mit verschiedenen Polypeptidketten, wie z.B. die embryonalen und fetalen Hb (Embryonalhämoglobin, Fetalhämoglobin), die im Laufe der Entwicklung zum adulten Organismus durch die Adult-Hb (Adulthämoglobin, Adultnebenhämoglobin) ersetzt werden ( ä vgl. Tab. , ä vgl. Abb. 4 ). Fetales Hb kann O2 schon bei geringerem O2-Partialdruck binden und stellt damit eine Anpassungsform an den in der Placenta herrschenden geringeren O2-Partialdruck dar (Blutkreislauf, fetaler Kreislauf). Auch das Hb der Kaulquappe ist gegenüber dem Hb des Frosches dem geringeren O2-Partialdruck seiner natürlichen Umgebung angepaßt. – Das Globin wird von mindestens 7 verschiedenen Strukturgenen codiert, die auf den Chromosomen 11 und 16 ( Chromosomenkarte I
Chromosomenkarte II
Chromosomenkarte III
Chromosomenkarte IV
, Globin-Gene) als Cluster (Gen-Cluster) vorliegen. Alle Menschenrassen und sogar die Schimpansen besitzen ein identisches Hämoglobin. Der Vergleich der Nucleotidsequenzen der Globin-Gene hat zur Aufstellung eines Hb-Stammbaums der Wirbeltiere sowie zum Postulat eines Ur-Globins geführt (Genfamilie). Der erblich bedingte Austausch einzelner Aminosäuren der Globinkomponenten führt häufig zu Hb von mehr oder weniger defekter Funktionsfähigkeit, was die Ursache bestimmter Erbkrankheiten (Hämoglobinopathien), wie z.B. der durch das Sichelzellenhämoglobin verursachten Sichelzellenanämie (Aminosäureaustausch) und der Thalassämien, ist. – Alternative Funktionen: Hämoglobine wurden auch in Pflanzen (Leghämoglobin) und manchen Bakterien gefunden. Die bakteriellen Hämoglobine scheinen bei aeroben Bakterien die Sauerstoffnutzung in sauerstoffarmer Umgebung zu verbessern. Die verblüffende strukturelle Ähnlichkeit der pflanzlichen und tierischen Hämoglobine läßt darauf schließen, daß es sich bei diesen Proteinen um uralte Moleküle handelt, die schon vor der Trennung von Pflanze und Tier in der Natur vorkamen (molekulare Evolution). Dabei deuten Untersuchungen am parasitisch lebenden Spulwurm darauf hin, daß das Hämoglobin ursprünglich nicht für den Sauerstofftransport zum Gewebe zuständig war, sondern vielmehr zur Entfernung des in freier Form toxischen Sauerstoffs und Stickstoffmonoxids benötigt wurde. Diese ursprüngliche Entgiftungsfunktion (Entgiftung) hat sich bei Säugern und Vögeln im Laufe der Evolution in eine Atmungsfunktion gewandelt. Ein Globin mit enzymatischer Funktion (Spaltung von Wasserstoffperoxid), die Dehaloperoxidase, konnte bei dem marinen Polychaeten Amphitrite ornata (Amphitrite) nachgewiesen werden. – Gentechnologische Darstellung: Bereits gelungen ist die gentechnologische Produktion (Gentechnologie) von humanem Hämoglobin in Tabakpflanzen (Tabak), wobei erstaunlicherweise sowohl die Produktion der für ein komplexes Hämoglobinmolekül benötigten Mengen der α- und β-Ketten als auch deren Anordnung um die Hämgruppe korrekt erfolgte, so daß ein voll funktionstüchtiges Hämoglobin aus Wurzel- und Samenextrakten der Pflanze isoliert werden konnte. Atmungsregulation, Barcroft (J.), Erythropoetin, Hämoglobinurie, Haptoglobine, Hoppe-Seyler (E.F.I.), Klug (A.), Lehmann (H.), Pauling (L.C.), Perutz (M.F.), Proteine, Svedberg (T.), Warburg (O.H.); ä Hämoglobine .
H.K./S.Kl.

Hämoglobine
Abb. 1: Anordnung und O2-Bindung der Häm-Gruppe im Hämoglobin
Hämoglobine
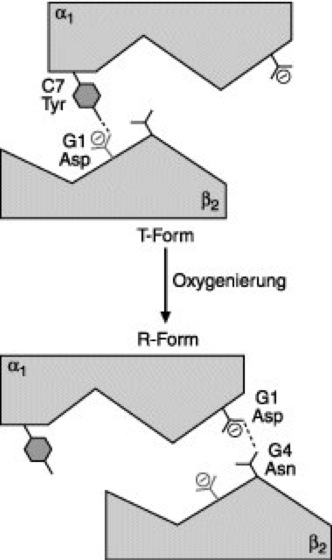
Abb. 2: Bei der Oxygenierung geht das Hämoglobin bzw. der Kontaktbereich von α1- und β2-Untereinheit von der T- (tense) in die R-Form (relaxed) über. Die Untereinheiten können aufgrund der sog. Schwalbenschwanzgestalt leicht beide Formen einnehmen.
Hämoglobine
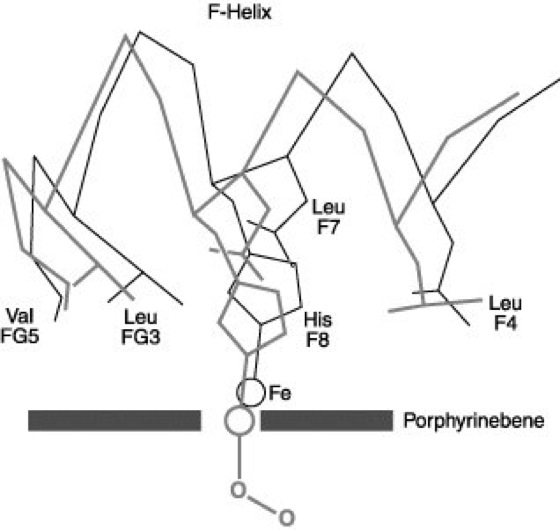
Abb. 3: Im desoxygenierten Zustand liegt das Häm-Eisenatom etwas außerhalb der Ebene des Porphyrinrings. Bei der Oxygenierung bewegt sich das Eisenatom in die Häm-Ebene hinein, wobei die Position des proximalen Histidinrestes (F8) und damit der ganzen F-Helix sowie der angrenzenden nichthelikalen Segmente (EF- und FG-Ecke) verschoben wird.
Hämoglobine
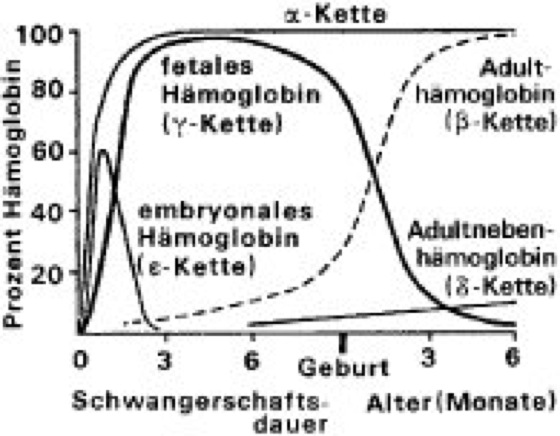
Abb. 4: Bildung der Polypeptidketten der verschiedenen Hämoglobine während der Individualentwicklung des Menschen. Die α-Ketten sind in allen Hämoglobinen enthalten.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.