Lexikon der Biologie: Phytochrom-System
Phytochrom-Systems [von *phyto- , griech. chrōma = Farbe], reversibles Hellrot-Dunkelrot-System, ein Sensorpigment-System (Pigmente), das es Pflanzen (Algen, Moosen, Farnen, Höheren Pflanzen) ermöglicht, sich durch Steuerung molekularer Regelungsabläufe (Regelung) an ihre Lichtumwelt (Lichtfaktor) anzupassen (z.B. Photomorphogenese, Samen-Keimung, vegetatives Wachstum, Photoperiodismus, Blütenbildung). Phytochrom (P) ist ein Chromoprotein mit photochromen Eigenschaften ( vgl. Infobox ), d.h., es läßt sich durch Licht verschiedener Wellenlänge reversibel in 2 Formen mit unterschiedlichen Absorptionsmaxima (bzw. Farben; Absorption) umwandeln (photoisomerisieren). Die eine Form, welche bei 660 nm absorbiert (Pr = Pred), kann durch Hellrotbestrahlung reversibel in die zweite Form mit einem Absorptionsmaximum im Dunkelroten bei 730 nm (Pfr = Pfar-red) überführt werden ( vgl. Abb. 1 ). Das monomere Chromoprotein (nativ ist es dimerisiert) besteht aus einem Polypeptid aus ca. 1200 Aminosäuren, welches in 11 verschiedene Domänen (A bis K) unterteilt werden kann ( vgl. Abb. 2 ) und eine relative Molekülmasse von 124.000 hat, sowie einem offenkettigen Tetrapyrrolderivat als Chromophor (chromophore Gruppen; vgl. Abb. 3 ). Die Phytochrome bilden eine Genfamilie; für Arabidopsis (Schmalwand) sind 5 Phytochromgene bekannt. Diese Phytochrome unterscheiden sich vor allem in ihrer Dynamik – während das Phytochrom A nach Belichtung abgebaut wird (photolabiles Phytochrom, früher auch Typ-I-Phytochrom genannt), bleiben die anderen Phytochrome im Licht stabil (photostabiles Phytochrom; früher auch Typ-II-Phytochrom). Die verschiedenen Phytochrome scheinen verschiedene physiologische Aufgaben zu besitzen, wobei sie jedoch in vielschichtiger Weise zusammenarbeiten (s.u.). Die Aktivierung des Phytochroms durch Rotlicht kann zu verschiedenen Primärreaktionen führen. Die entsprechenden Signalketten überlappen, allerdings wurden auch Signalkomponenten isoliert, die bestimmten Phytochromen zugeordnet sind. Aufgrund der Photoreversibilität durch rotes bzw. dunkelrotes Licht lassen sich die Phytochrome leicht spektroskopisch im Gewebe nachweisen und messen. Da in dunkelgewachsenen Keimlingen das Phytochrom A dominiert, wurden solche Messungen mit den beobachteten physiologischen Wirkungen in Beziehung gesetzt, was zu zahlreichen Widersprüchen (sog. „Phytochromparadoxa“) führte. Erst als in neuerer Zeit aufgrund von Mutantenanalysen die Funktionen der anderen, spektroskopisch nur schwer nachzuweisenden Phytochrome entdeckt wurden, ließen sich diese Widersprüche auflösen. Phytochrom A ist in der nicht aktivierten Form diffus im Cytoplasma verteilt; nach Belichtung aggregiert es innerhalb weniger Minuten in kleine Partikel (Sequestrierung) und wird in den Zellkern transportiert, wo es die Aktivität verschiedener Transkriptionsfaktoren steuert und so die Hemmung der Photomorphogenese abschaltet. Es entfaltet seine Wirkung also über Genaktivierung. Daneben gibt es jedoch noch eine direkte, schnelle Wirkung des Phytochroms, die nicht auf Genaktivierung beruht (Beispiel Chloroplastendrehung bei der Jochalge Mougeotia [Zygnemataceae]). Auch für einige der anderen Phytochrome wird ein Kerntransport beobachtet; sie scheinen aber auch in der Plasma-Membran vorzukommen. – Photostabile Phytochrome wurden schon früh in der Evolution entwickelt; das urtümlichste Phytochrom läßt sich schon bei den Cyanobakterien nachweisen. Hier scheint die Signaltransduktion über Kinase-Kaskaden des sog. Zweikomponentensystems zu laufen. Phytochrom A wurde dagegen erst spät entwickelt und scheint auf die Bedecktsamer beschränkt zu sein. – Physiologisch lassen sich folgende Wirkweisen des Phytochromsystems beobachten ( vgl. Abb. 4 ), die noch durch andere Photorezeptor-Systeme beeinflußt werden können. 1) Der bekannteste Modus ist die sog. „Revertierungsreaktion“ in etiolierten Geweben (Etiolement), wobei Phytochrom in der inaktiven Pr-Form durch eine sättigende Bestrahlung mit Hellrot (HR) zu ca. 80% (überlappende Absorptionsspektren von Pr und Pfr verhindern vollständige Photokonversion) in die reaktive Pfr-Form überführt wird. In den Epidermen der Unterseiten von Keimblättern bei Senfkeimlingen, welche das richtige Alter besitzen, würde man am nächsten Tag eine Rötung (Anthocyane, Phenylalanin-Ammonium-Lyase) feststellen können. Gibt man nach dem Hellrotpuls einen sättigenden Dunkelrotpuls (DR), so kann die zu erwartende physiologisch-biochemische Reaktion nicht nur stark oder voll unterdrückt werden; bei darauf folgenden Bestrahlungsprogrammen verhält sich die entsprechende Pflanze so, als wäre sie noch gar nicht bestrahlt worden – in ihrer Reaktionspotenz ist sie somit voll revertiert worden. Diese Reaktion wurde früher dem Phytochrom A zugeschrieben, scheint aber vor allem durch die photostabilen Phytochrome verursacht zu sein. 2) Mit äußerst geringen Fluenzen läßt sich das Hypokotyllängenwachstum – nicht revertierbar – hemmen (Keimling erreicht Erdoberfläche bzw. durchbricht Blattschicht). Diese sog. very low fluence response geht auf das Phytochrom A zurück. 3) Die Hochintensitätsreaktion (high irradiance response; HIR). Hier werden die Photomorphosen durch eine ausgedehnte Dunkelrotbestrahlung (ohne Revertierungsmöglichkeit) verursacht. Das Phänomen ist vor allem bei etiolierten Pflanzen zu beobachten und verschwindet mit anhaltender Bestrahlung. Die HIR geht auf das photolabile Phytochrom A zurück. 4) Endogene Rhythmen (endogene Rhythmik) in lichtgewachsenen Pflanzen können durch Phytochrom beeinflußt werden (z.B. Blütenbildung bei Kurztag-und Langtagpflanzen; Blühinduktion) und sind teilweise HR/DR-revertierbar. Hierbei wirken Phytochrom A und B zusammen und werden durch die Kryptochrome (Blaulichtrezeptor) mit beeinflußt. 5) Lichtgewachsene Pflanzen besitzen die Fähigkeit, das Verhältnis der Strahlungsintensitäten im hellroten und dunkelroten Bereich über das aktuelle Verhältnis der Konzentrationen von Pr zu Pfr zu bestimmen. Diese Eigenschaft erlaubt der Pflanze das Erkennen von beschattender Vegetation (grüne Pflanzenteile reflektieren und emittieren dunkelrotes Licht, während hellrotes Licht absorbiert wird), worauf eine sog. „shade avoidance“-Reaktion (gesteigertes Längenwachstum) erfolgt – eine wichtige Fähigkeit bei der Konkurrenz um Licht. Diese Funktion scheint vor allem vom Phytochrom A vermittelt zu werden. Destruktion, Polarotropismus, Zellstrahlung, Ubiquitin.
B.La./P.N.

Phytochrom-System
Abb. 1: Absorptionsspektren von Pr und Pfr
Phytochrom-System
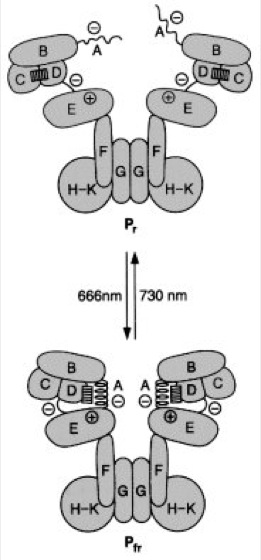
Abb. 2: Strukturmodell des Phytochrom-Holoproteins in seinen beiden Formen: Der Chromophor ist als Rechteck (nicht maßstabsgerecht) eingezeichnet. Die Plus- und Minus-Zeichen deuten Regionen mit entsprechenden Ladungskonzentrationen in der Polypeptidkette an. Von der Photokonversion sind besonders die Domänen A bis D betroffen. Auch der Chromophor verändert seine Lage.
Phytochrom-System
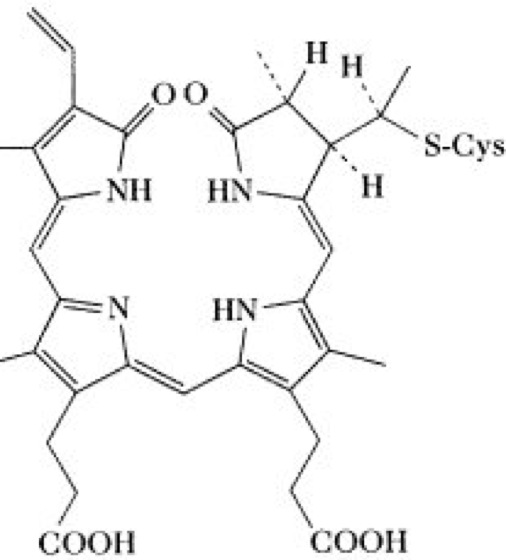
Abb. 3: Chromophor des Phytochroms; er ist strukturell mit dem Chromophor von Phycocyanin verwandt.

Phytochrom-System
Abb. 4: Die 3 Typen der Phytochromreaktionen in Abhängigkeit steigender Bestrahlung (Lichtfluß, Fluenzrate) mit hellrotem Licht (HIR = Hochintensitätsreaktion, LFR = low fluence rate, VLFR = very low fluence response). Bei der HIR sind 3 verschiedene Strahlungsintensitäten dargestellt.

Phytochrom-System
Abb. 5: Antagonistische Wirkung der Phytochrome A und B. a Rolle von hellrotem und dunkelrotem Dauerlicht bei der De-Etiolierung eines Keimlings. b Einfluß von Phytochrom A und B auf die Entwicklung von Keimlingen bei unterschiedlichen Lichtverhältnissen. Bei voller Bestrahlung mit einem hohen Rotlichtanteil ist Phytochrom B für die De-Etiolierung verantwortlich (links). Unter einer Blätterschicht ist der Anteil dunkelroten Lichts erhöht. Dadurch wird Phytochrom A mit niedriger Effizienz aktiviert, so daß nur ein geringer Teil des aktivierten Phytochroms A der Photodestruktion unterliegt (Mitte). Das Sproßwachstum wird hauptsächlich über Phytochrom B gesteuert. Das aktivierte Phytochrom A führt nun durch einen bislang noch nicht wirklich verstandenen Antagonismus zu einer Hemmung des Phytochrom-B-Signalwegs. Dadurch wird die Hemmung des Sproßwachstums aufgehoben (Schattenmeidereaktion, Schattenfluchtreaktion oder shade-avoidance Reaktion; rechts).
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.