Lexikon der Ernährung: Cholesterin
Cholesterin, Echolesterol, als wesentlicher Bestandteil von Zellmembranen in allen menschlichen Organen vorkommendes komplexes Kohlenwasserstoffmolekül, das der Körper zum Membranaufbau und zur Synthese von Gallensäuren, Vitamin D (Calciferole) sowie wichtigen Steroidhormonen benötigt.
Struktur: Chemisch leitet sich das C. von einem Sterangerüst, dem Gonan, ab. Dieses ist ein wasser-unlösliches Molekül aus drei nicht-aromatischen Kohlenwasserstoffsechsringen und einem Fünfring. C. weist zusätzlich am Fünfring eine Kohlenwasserstoffseitenkette und an einem Sechsring eine funktionell bedeutsame Hydroxylgruppe auf.
Aufnahme und Stoffwechsel: C. wird enteral aus tierischen Nahrungsmitteln aufgenommen (Tab.). Die Resorptionskapazität im Dünndarm beträgt maximal 3 g / d. Im Gegensatz zu Pflanzen und Prokaryonten kann der Mensch zusätzlich C. synthetisieren. Hierzu sind alle Körperzellen befähigt, den Hauptsyntheseort stellt jedoch die Leber dar; in der Nebennierenrinde und in den Gonaden findet zudem ein hoher Cholesterinumsatz statt, da dort Steroidhormone gebildet werden.
Die Leber bildet das zentrale Organ im Cholesterinstoffwechsel, da dort auch der Cholesterinabbau zu Gallensäuren und deren Ausscheidung stattfinden. Täglich wird ca. 1 g C. ausgeschieden, indem es zu Gallensäuren abgebaut wird. Der größte Anteil des mit der Lebergalle (Galle) ausgeschiedenen C. wird hierbei durch die hepatische Resynthese (0,7 g / Tag) kompensiert, über die Nahrung werden ca. 0,3 g / Tag beigesteuert.
Das in der Leber produzierte C. wird dort in Lipoproteine (VLDL) verpackt. Nach Sekretion in Form von zunächst fettreichen VLDL wird C. – nach Lipoprotein-Lipase-vermittelter Delipidierung zu cholesterinreichem LDL – über den LDL-Rezeptor in die peripheren Zellen aufgenommen. Dort wird es entweder in die Zellmembranen eingebaut, intrazellulär gespeichert oder zur Synthese von Steroidhormonen verwendet (in Nebenniere, Gonaden). Die intrazelluläre Speicherung erfolgt in veresterter Form (Cholesterinester). Hierzu erfolgt an der freien OH-Gruppe durch das Enzym Acyl-CoA-Cholesterin-Acyl-Transferase (ACAT) die Versterung mit Fettsäuren.
Überschüssiges, vom peripheren Gewebe nicht benötigtes LDL-Cholesterin rezirkuliert zur Leber, die ca. 50 % der gesamten LDL-Rezeptorkapazität stellt. Ein allerdings nicht unbeträchtlicher Anteil (ca. 1/3) wird dabei auch nicht-LDL-Rezeptor-vermittelt (scavenger pathway) in das retikuloendotheliale System (z. B. Makrophagen) aufgenommen. Überschüssiges C. kann aber auch direkt aus der Zellmembran abgeholt werden. Der Rücktransport erfolgt über HDL-Partikel, die den reversen Cholesterintransport durchführen.
Synthese: Die Synthese von C. (27 C-Atome) erfolgt aus dem Acetyl-Coenzym-A, das die Quelle aller C-Atome darstellt. Drei Moleküle Acetyl-CoA werden zu β-Hydroxy-β-Methylglutaryl-CoA (HMG-CoA) kondensiert, das durch die HMG-CoA-Reduktase unter NADPH-Verbrauch zu Mevalonsäure reduziert wird (Abb. 1). Nach ATP-abhängiger Phosphorylierung entsteht das wesentliche Zwischenprodukt Isopentenylpyrophosphat („aktives Isopren“), ein C5-Körper. Die Polymerisierung von 6 aktivierten Isoprenmolekülen ergibt einen C-30 Körper, das Squalen, das noch nicht ringförmig angelegt ist (Abb. 2). In einer Umlagerungsreaktion bilden sich dann die drei Sechsringe und der Fünfring aus, womit die Gonanstruktur (früher als Steranstruktur bezeichnet) bereits vorliegt. Nach dreimaliger Demethylierung und Einfügen einer OH-Gruppe an typischer Stelle (C-Atom in Position 3) ist die C.-Biosysnthese abgeschlossen (Abb. 3).
Der geschwindigkeitsbestimmende Schritt bei der Cholesterinsynthese ist die Aktivität der HMG-CoA-Reduktase. Ihre Hemmung durch sog. CSE-Inhibitoren (Statine; Cholesterinbiosynthesehemmer) führt daher zu einer wesentlichen Beeinflussung der Cholesterinhomöostase, wodurch die bei Hypercholesterinämien gewünschte Senkung des LDL-Cholesterins erzielt wird. Die Aktivität der HMG-CoA-Reduktase unterliegt circadianer Rhythmik mit einem Aktivitätsmaximum um 24.00 Uhr. Vermehrt intrazellulär angebotenes (unverestertes) C. supprimiert die HMG-CoA-Reduktaseaktivität. Der Plasmacholesterinspiegel wird aber nicht nur von der Lebersynthese reguliert, sondern hängt in weit höherem Maße von der LDL-Rezeptoraktivität ab. HMG-CoA-Reduktase und LDL-Rezeptoraktivität beeinflussen sich hierbei gegenseitig: bei einer cholesterinarmen Ernährung kommt es z. B. zu einer Cholesterinmehrsynthese über die HMG-CoA-Reduktase, jedoch auch zu einer vermehrten Expression der LDL-Rezeptoren, wodurch es netto durch vermehrte (rezeptorvermittelte) Cholesterinaufnahme in die Zellen zu einem Absinken des Plasmacholesterinspiegels kommt. Wird dagegen cholesterinreich gegessen, so wird die HMG-CoA-Reduktase gehemmt, die LDL-Rezeptoranzahl jedoch vermindert, so dass es netto zu einem Anstieg des Plasmacholesterinspiegels kommt.
Bedeutung bei der Entstehung von Arteriosklerose: Ein erhöhter Plasmacholesterinspiegel (Blutcholesterinkonzentration) trägt zur Arteriosklerose bei und stellt daher einen klassischen kardiovaskulären Risikofakor dar. Nach den Ergebnissen mehrer Interventionsstudien kann durch die Senkung des Cholesterinspiegels um 1 % eine Reduktion des Risikos koronarer Herzkrankheiten um 2 % erzielt werden. Die Ursachen eines erhöhten Cholesterinspiegels (Hypercholesterinämie) sind vielfältig; bei schweren Formen (familiäre Hypercholesterinämie) liegt meist eine verminderte LDL-Rezeptoraktivität vor, die zu einer reduzierten Aufnahme von LDL-C. in die Zelle führt. Nicht aufgenommenes LDL-C. wird daher vermehrt in die Gefäßwände eingelagert oder über Scavenger-Rezeptoren (s. o.) in Monocyten und andere histiocytäre Zellen aufgenommen, die in die Gefäßwand einwandern und sie dann als sog. Schaumzellen schädigen.
Cholesterin: Abb. 1. Erste Phase der Cholesterinsynthese. [Aus G. Rehner u. H. Daniel, Biochemie der Ernährung, Spektrum Akademischer Verlag, Heidelberg, Berlin, 1999] Cholesterin
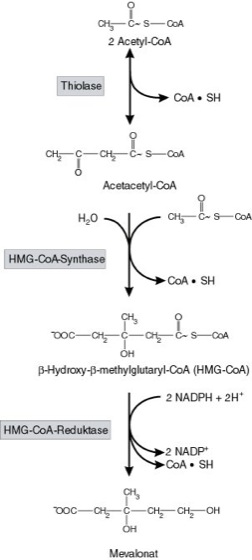
Cholesterin: Abb. 2. Zweite Phase der Cholesterinsynthese. [Quelle: s. Abb. 1] Cholesterin
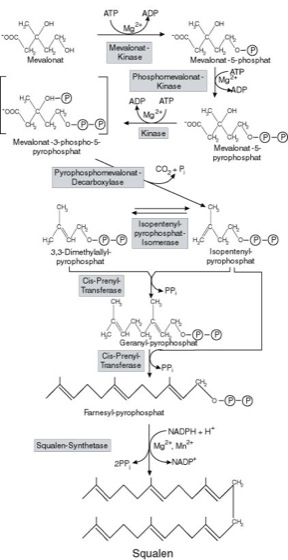
Cholesterin: Abb. 3. Dritte Phase der Cholesterinsynthese. [Quelle: s. Abb. 1] Cholesterin
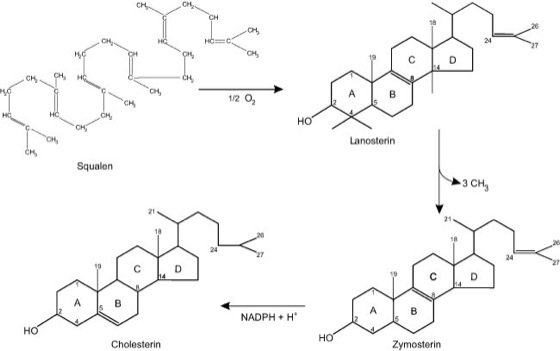
Cholesterin: Tab. Lebensmittel mit hohem Cholesteringehalt [modifiziert nach P. Schwandt u. W.O. Richter, Fettstoffwechselstörungen, 2. Aufl., Wissenschaftl. Verl.-Ges., Stuttgart 1998]
| |||
| Hirn | 2000 | ||
| Eigelb | 1260 | ||
| Hühnerei | 396 | ||
| Rinderniere | 358 | ||
| Leber | 300 | ||
| Biskuit | 248 | ||
| Butter | 240 | ||
| Lunge | 150 | ||
| Garnele | 144 | ||
| Hummer | 135 | ||
| Standardmargarine | 115 | ||
| Sahne | 109 | ||
| Gorgonzola | 102 | ||
| Camembert, 60 % F. i. Tr. | 80 | ||
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.