Lexikon der Geowissenschaften: Meerwasser
Meerwasser, umfaßt rund 97% aller Wasservorräte unseres Planeten. Da Meerwasser zum überwiegenden Teil (96,5%) aus reinem Wasser besteht, sind seine physikalischen Eigenschaften vor allem von denen des reinen Wassers bestimmt. Die Farbe des Meerwassers wird bestimmt durch das aus dem Wasserkörper zurückgestreute Licht, wobei das von der Oberfläche reflektierte Licht ausgeschlossen ist. Reines Meerwasser ist blau wegen des Minimums der Attenuation und hoher Streuung bei einer Wellenlänge von ca. 475·10-9 m (Wüstenfarbe des Meeres). Bei zunehmender Menge insbesondere organischer Substanzen verschiebt sich das Minimum der Attenuation und damit die Wasserfarbe in Richtung gelb/grün.
Über Jahrhunderte war das Wasser "die Flüssigkeit" schlechthin (Substanzen wie Öl oder Quecksilber spielten nur eine untergeordnete Rolle), so daß man seine Eigenschaften schon frühzeitig in der Wissenschaft der Neuzeit als Eichwerte verwendete, wie z.B. die Celsius-Temperaturskala oder die Maßsysteme für Volumen und Gewicht. Erst mit der physikalischen Untersuchung weiterer Flüssigkeiten erkannte man, daß Wasser keine "typische Flüssigkeit" ist und z.B. die feste Phase, das Eis, eine um etwa 10% geringere Dichte hat als flüssiges Wasser und daher auf dem Wasser schwimmt. Im Gegensatz zu normalen Flüssigkeiten nimmt die Dichte von Wasser nach dem Schmelzpunkt zu und erreicht bei 4ºC ein Dichtemaximum (Meerwasserdichte). Diese Tatsache ist in der Natur von außerordentlicher Bedeutung. So kühlt sich das Wasser von Seen bei Frostperioden nur bis 4ºC ab, sinkt als schwereres Wasser nach unten und verdrängt dabei das leichtere wärmere Wasser, das dann an die Oberfläche kommt. Bei Abkühlung unter 4ºC bleibt das kältere Wasser an der Oberfläche und erstarrt dort zu bleibendem Eis, das als isolierende Schicht ein weiteres Abkühlen des darunter liegenden Wassers fast vollständig verhindert, so daß tiefere Gewässer nie bis zum Grund frieren. Sind Wassermassen unterschiedlicher Temperatur und unterschiedlichen Salzgehaltes, aber ähnlicher Dichte, übereinandergeschichtet, kann der Unterschied in der Diffusion von Wärme und Salz zu Instabilitäten führen. Dabei können Salzfinger und damit Treppenstrukturen in der Schichtung entstehen, deren vertikale Ausdehnung in der Größenordnung von Metern liegt. Bei Meerwasser weicht die maximale Dichte um so stärker von 4ºC ab, je salzhaltiger das Wasser ist. Bei ozeanischem Salzgehalt von 3,5% gefriert das Wasser sogar vor Erreichen seiner maximalen Dichte, d.h. theoretisch könnte der Ozean bis zum Grund gefrieren. Allerdings verhindert in der Natur sein großer Wärmehaushalt ein Gefrieren. Eisbildung tritt daher bevorzugt nur in sehr flachen Meeresgebieten sowie in den Polargebieten auf (Meereis). Eine besonders eindrucksvolle Anomalie des Wassers läßt sich beim Vergleich der Schmelz- und Siedetemperaturen mit den Daten verwandter Substanzen erkennen. Daraus läßt sich ableiten, daß Wasser als "normale" Flüssigkeit eigentlich einen Siedepunkt von ca. -100ºC haben sollte und bei den vorherrschenden Temperaturen nur als Gas existieren könnte. Die Schmelz- und Verdampfungswärmen sind beträchtlich höher als bei anderen Flüssigkeiten. Meerwasser-Eindampfung führt zur Kondensation und Ausfällung der gelösten Salze und anderer Verbindungen und zur Ablagerung von Evaporiten. Marine Evaporite bilden eine Ausscheidungsabfolge, die den jeweiligen Grad der Eindampfung widerspiegelt und sich umgekehrt zur Löslichkeit verhält. Auf eine klastische, tonige Sedimentation folgt die chemische Carbonatbildung (Calcit, Dolomit), dann die Gipsfällung (Eindampfung von 70% des Meerwassers), Halitfällung (89% Eindampfung) und Kalisalzbildung (Carnallit). Den Abschluß der Ausfällung bildet der am leichtesten lösliche Bischoffit (MgCl2·6H2O). Umgekehrt werden auch größere Wärmemengen frei, wenn Wasser gefriert oder Wasserdampf kondensiert. So können von den Ozeanen große Wärmemengen gespeichert und wieder abgegeben werden. Das Meerwasser stellt deshalb einen Wärmepuffer dar, der extreme Temperaturschwankungen, wie z.B. auf der Mondoberfläche, verhindert und mit Hilfe von Meeresströmungen und atmosphärischen Strömungen für einen Wärmeausgleich zwischen den niedrigen und hohen Breiten unseres Planeten sorgt.
Die Ursache für diese wichtigen Anomalien des Wassers bildet die Polarität des Wassermoleküls. Sie läßt sich dadurch erklären, daß die stärkere Anziehung der Bindungselektronen durch den Kern des Sauerstoffs (O) zu einer Verschiebung der Elektronen der O-H-Bindungen führt (mit einem Winkel von 105º). Als Folge verhält sich das Wassermolekül wie ein Dipol, d.h. es trägt eine positive und eine negative Partialladung. Durch dieses Dipolmoment des Wassermoleküls kommt es zu einer Wechselwirkung mit anderen Wassermolekülen, bei der ein Wasserstoff-Atom so etwas wie eine "Vermittlerrolle" übernimmt, die man als Wasserstoff-Brückenbindung bezeichnet. So kommt es zur Verknüpfung von mehreren Molekülen, die das anomale Verhalten des Wassers qualitativ erklären kann. Allerdings ist es bisher nicht gelungen, die genaue Struktur des flüssigen Wassers aufzuklären, wohingegen das Kristallgitter des Eises bekannt ist. Alle vorgeschlagenen Modelle beschreiben nur einen Teil der beobachteten Wassereigenschaften. Es besteht also die kuriose Situation, daß die Struktur der Substanz, auf deren Eigenschaften das irdische Leben beruht, weitgehend unbekannt geblieben ist.
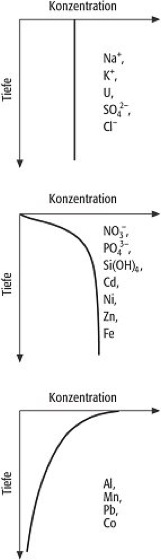
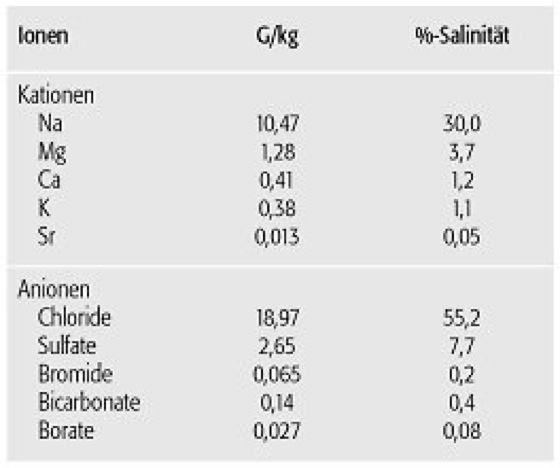
Durch das Auftreten unterschiedlicher Isotope beim Wasserstoff (1H, 2H, 3H) und Sauerstoff (16O, 17O, 18O) besteht das in der Natur vorkommende Wasser aus einem Gemisch verschiedener Wasserarten, deren Häufigkeiten gegenüber dem normalen Wasser (1H16O) allerdings relativ gering sind. Aufgrund ihrer unterschiedlichen physikalischen Eigenschaften kommt es aber in der Natur zur partiellen Fraktionierung des Wassergemisches bei der Verdunstung, so daß die Veränderung der Isotopenverhältnisse Rückschlüsse auf die Herkunft des Wassers und auch auf das Klimageschehen erlaubt. Aufgrund der erwähnten hohen Polarität besitzt Wasser ein großes Dissoziationsvermögen, d.h. die Fähigkeit zur Aufspaltung gelöster Stoffe in elektrisch geladene Ionen. Im Meerwasser sind inzwischen alle natürlich vorkommenden chemischen Elemente nachgewiesen worden, in einem Konzentrationsbereich, der mehr als 15 Zehnerpotenzen umfaßt. Nur 11 Elemente bzw. ihre Verbindungen bilden mehr als 99% des Salzgehaltes ( Tab. ). Man bezeichnet sie als die Hauptbestandteile des Meersalzes oder auch als die konservativen Elemente, da sie stets im gleichen Mengenverhältnis untereinander auftreten. Die verbleibenden Anteile werden als Spurenelemente bezeichnet. In den Ozeanen verläuft die Konzentrationsverteilung der Elemente mit der Tiefe im wesentlichen nach drei Mustern mit allen möglichen Übergängen ( Abb. 1 ). Die im Weltmeer berechneten Aufenthaltszeiten der einzelnen Elemente liegen zwischen 106-108 Jahren bei den Hauptbestandteilen und bei z.T. weniger als 100 Jahren für einige Spurenelemente. Es gilt heute als gesichert, daß dieses Verhalten verursacht wird durch die unterschiedliche chemische Affinität der Elemente zu den Partikeln der Wassersäule (Schwebstoffe, Detritus), was als Folge davon zu einer mehr oder weniger schnellen Sedimentation der Komponenten aus der Wassersäule führt. Im Meerwasser enthaltene Gase lassen sich grundsätzlich unterteilen in Gase, die sich inert verhalten, d.h. im Meerwasser keinen oder vernachlässigbaren biologisch-chemischen Reaktionen unterliegen, und in reaktive Gase, die beim Auf- und Abbau von organischer Materie in den obersten Wasserschichten beteiligt sind oder von den Organismen als Stoffwechselprodukte gebildet werden oder die einfach nur mit H2O reagieren. Es herrscht Gleichgewicht, wenn die Partialdrucke eines Gases in Atmosphäre und Wasseroberfläche identisch sind. Nach dem Henryschen Gesetz ist dann die Löslichkeit eines Gases im Wasser c bei gegebener Temperatur proportional seinem Partialdruck p in der Gasphase:
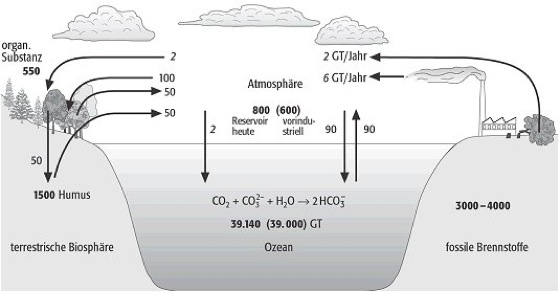
c = k·p.
Der Löslichkeitskoeffizient k ist gasspezifisch und temperaturabhängig. Er steigt mit wachsendem Molekulargewicht der Gase. Grundsätzlich gilt, daß die Löslichkeit eines Gases mit zunehmender Temperatur und steigendem Salzgehalt abnimmt, aber mit zunehmendem Druck ansteigt. Die Konzentrationsverhältnisse der Gase können sich beim Übergang von der Atmosphäre ins Meerwasser stark verändern ( Abb. 2 ). So beträgt das Verhältnis der gelösten Gase von Stickstoff (N2) und Sauerstoff (O2) im Gleichgewicht (bei 24ºC) etwa 1,7:1, während das Partialdruckverhältnis dieser beiden häufigsten Gase in der Atmosphäre bei etwa 4:1 liegt, d.h. O2 ist im Meerwasser doppelt so gut löslich wie N2. Kohlendioxid ist im Mittel rund 30 mal löslicher als Argon (Ar). Die Ursache hierfür liegt in der chemischen Reaktion des CO2 mit dem Wasser bzw. Carbonatsystem. Der Transport der Gase aus der Oberflächenschicht in größere Tiefen des Ozeans erfolgt hauptsächlich durch Strömung und Vermischungsprozesse, weniger durch Diffusion. Bei den reaktiven Gasen O2 und CO2 wird der Konzentrationsverlauf mit der Tiefe jedoch weitgehend beherrscht von biologischen Abbauprozessen, die in einigen Regionen zu starken Sauerstoffdefiziten und sogar zur Bildung vonSchwefelwasserstoff führen können (anaerobe Bedingungen). Eine dauerhafte Übersättigung gegenüber den atmosphärischen Konzentrationen findet man dagegen für eine Reihe von Spurengasen. Sie entstehen hauptsächlich bei der Planktonbildung und durch Bakterientätigkeit in der Oberflächenschicht von Gewässern, so daß zur Einstellung des Gleichgewichts ein ständiger Gastransport in die Atmosphäre stattfindet. Zu diesen Gasen gehören z.B. Kohlenmonoxid (CO), Distickstoffmonoxid (N2O) oder Dimethylsulfid ((CH3)2S) und eine Reihe von halogenierten Kohlenwasserstoffen wie Methyliodid (CH3I) oder Bromoform (CHBr3). Die schwefel- und halogenhaltigen Verbindungen werden allerdings in der Atmosphäre unter dem Einfluß der ultravioletten Strahlung relativ schnell abgebaut. Das Meerwasser enthält auch eine große Gruppe gelöster organischer Spurenstoffe, deren Gesamtkonzentration (im Bereich von ca. 1 mg/L) in der Oberflächenschicht des Ozeans starken räumlichen und zeitlichen Schwankungen unterworfen ist und weitgehend von den internen biochemischen Stoffkreisläufen im Ozean kontrolliert wird. Den Hauptanteil bilden in ihrer Zusammensetzung bisher unbekannte hochmolekulare Verbindungen wie die Huminstoffe. Von den bekannten Verbindungen (ca. 10-15%) sind Kohlenhydrate, Aminosäuren und Peptide am besten untersucht. Daneben hat man Lipide, Fettsäuren, Kohlenwasserstoffe, Sterole, Vitamine und zahlreiche andere Verbindungen nachweisen können. Die Geochemiker gehen davon aus, daß für die meisten anorganischen chemischen Komponenten des Weltmeeres seit Jahrmillionen das "steady state"-Prinzip gilt, d.h. daß sich die Zufuhr der Elemente und Verbindungen, die hauptsächlich über die Flüsse, Atmosphäre und hydrothermale Quellen erfolgt, im Gleichgewicht befindet mit ihrer Entfernung aus der Wassersäule (z.B. durch Sedimentation). Dadurch bleibt die Gesamtmenge in den Ozeanen konstant. Dieses Gleichgewicht kann durch massive anthropogene Störungen außer Kraft gesetzt werden. Beispiele hierfür bilden die über mehrere Jahrzehnte stattgefundene erhöhte Bleizufuhr infolge immittierter Autoabgase, die in der Deckschicht des Weltmeeres zu einer ca. 25-fachen Konzentrationserhöhung dieses Elementes geführt hatten. Eine Störung des natürlichen Gleichgewichts läßt sich auch beim globalen Kohlenstoffkreislauf beobachten ( Abb. 3 ). Es zeigt sich, daß der Ozean das bei weitem größte natürliche Kohlenstoffreservoir darstellt, das aufgrund der dargestellten chemischen Reaktion ein gewaltiges Aufnahmepotential für anthropogenes Kohlendioxid besitzt. Aufgrund der langen Durchmischungszeiten der Ozeane kann dieses allerdings nur in Zeitskalen von Jahrhunderten ausgeschöpft werden. Die Verweilzeit des Meerwassers ist die durchschnittliche Dauer von der Bildung einer von der Meeresoberfläche abgeschnittenen Wassermasse bis zur Rückführung an die Oberfläche oder der Mischung in andere Wasserkörper (Zirkulationssystem der Ozeane). Die Meerwasserverweilzeit der Tiefenwässer im Atlantik und Indischen Ozean beträgt etwa 250 Jahre, im Pazifik rund 500 Jahre. Die dichtesten Bodenwässer erreichen Verweilzeiten von mehr als 1000 Jahre. Im Entstehungsgebiet der Tiefenwassermassen ist der Sauerstoffgehalt noch hoch und die Nährstoffkonzentration gering. Biologische und sedimentologische Prozesse bewirken mit zunehmendem Alter eine Abnahme des Sauerstoffgehaltes bei zunehmender Nährstoffanreicherung.
Literatur: [1] Libes, S.M. (1992): An Introduction to Marine Biogeochemistry. – New York. [2] Summerhayes, C.P. & Thorpe, S.A. (1996): Oceanography – An Illustrated Guide. – Southampton. [3] Grasshoff, K., Kremling, K. & Ehrhardt, M. (eds.)(1999): Methods of Seawater Analysis. – Weinheim.
Meerwasser 1: die Vertikalverteilung der chemischen Elemente im Ozean. Meerwasser 1:
Meerwasser 2: Partialdrucke der vier häufigsten Gase in der Atmosphäre und ihre Gleichgewichtskonzentrationen im Meerwasser. Meerwasser 2:

Meerwasser 3: Dargestellt sind die innerhalb von Jahrzehnten bis Jahrtausenden austauschenden Kohlenstoffreservoire Atmosphäre, Ozean und terrestrische Biosphäre, die geschätzten Vorräte an fossilen Brennstoffen sowie die anthropogene Verbrennung fossiler Brennstoffe und eine geänderte Landnutzung (rechts), mit Reservoirgrößen (in Gt) für den heutigen, anthropogen gestörten Kohlenstoffkreislauf (fett) und den vorindustriellen, natürlichen Zustand (in Klammern). Die Pfeile zeigen die jährlichen Austauschflüsse. Für die terrestrische Biosphäre sind die Kohlenstoffreservoire des Pflanzenbestandes oberhalb des Bodens sowie des Kohlenstoffs im Boden (Humus) getrennt dargestellt (kursiv = anthropogen). Meerwasser 3:
Meerwasser (Tab.): Kationen- und Anionengehalt von Meerwasser. Meerwasser (Tab.):
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.