Lexikon der Biologie: Atmungskette
Atmungskette, die aus zahlreichen Einzelschritten aufgebaute Kette von chemischen Redoxreaktionen, die durch ein Multienzymsystem (Multienzymkomplexe) der inneren Mitochondrienmembran (Mitochondrien), bei prokaryotischen Mikroorganismen der Cytoplasmamembran (nach der Endosymbiontenhypothese der inneren Mitochondrienmembran homolog), katalysiert wird und in deren Verlauf Elektronen von NADH (E0´ NAD+/NADH · H+ = –320 mV) auf Sauerstoff übertragen werden, welcher mit 2 Protonen (H+) zu Wasser reduziert wird (E0´ 1/2O2/H2O = +815 mV). Dies entspricht einer freien Energie ΔG0´ von –220 kJ pro mol. Parallel hierzu wird ein Protonengradient über die Membran aufgebaut, der die ATP-Synthese antreibt. Die direkte Oxidation von Wasserstoff (bekannt als Knallgasreaktion: 2H2+O2![]()
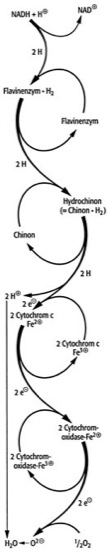
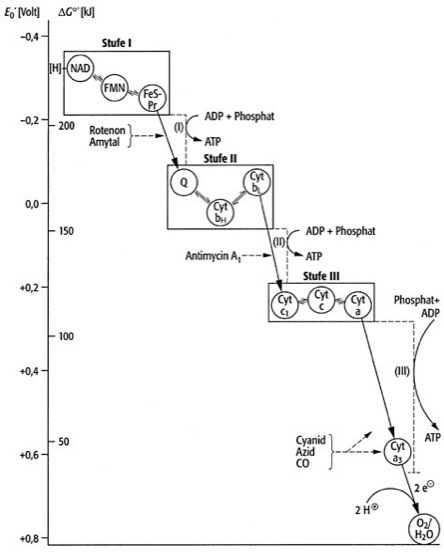
2H2O) verläuft explosionsartig und ist daher als zelluläre Energiequelle nicht geeignet. Durch die Atmungskette wird die Knallgasreaktion in zahlreiche, unter physiologischen Temperaturen ablaufende Einzelschritte zerlegt, wodurch die frei werdende Energie in kleinen und daher durch die Zelle kontrollierbaren bzw. durch Überführung in ATP (Adenosintriphosphat) verwertbaren Portionen anfällt. – Die Atmungskette ist das Herzstück der Zellatmung bzw. des Energiestoffwechsels, da die Hauptmenge des ATPs durch die sog. Atmungskettenphosphorylierung gebildet wird. Die wichtigsten Einzelschritte der Atmungskette sind in Abb. 1 ( vgl. Abb. ) zusammengefaßt. Ausgangssubstrat ist NADH, das bei zahlreichen Reaktionen des Zellstoffwechsels anfällt und [zusammen mit einem Proton (H+)] als gebundener Wasserstoff aufzufassen ist. In einem ersten Schritt wird an der NADH-Dehydrogenase (Komplex I) NADH oxidiert, wobei 2 Elektronen (zusammen mit 2 Protonen) auf ein Flavinenzym (FMN; Flavinmononucleotid) übertragen werden, das dabei in den reduzierten Zustand (FMNH2; Flavinenzym · H2) übergeht. Von diesem durchlaufen die Elektronen mehrere Redoxreaktionen und werden schließlich auf Coenzym Q, ein Chinon (Ubichinone), übertragen, das dabei unter Aufnahme von 2 Protonen auf der Matrixseite der Membran (innen) in den reduzierten Zustand eines Hydrochinons (Chinon · H2) übergeht. Die beiden Protonen des FMNH2 werden auf der cytoplasmatischen Seite der Membran (außen) abgegeben. Das Hydrochinon diffundiert innerhalb der Membran zu dem Cytochrom-bc1-Komplex (Komplex III) und wird an der Außenseite der Membran unter Abgabe von 2 Protonen oxidiert. Über mehrere Redoxkomponenten (Cytochrome, Eisen-Schwefel-Proteine) wird ein Elektron auf Cytochrom c (Cytochrome) in der oxidierten Form (Fe3+) unter Ausbildung der reduzierten Form (Fe2+) übertragen. Innerhalb des Cytochrom-bc1-Komplexes findet eine als Chinon-Zyklus bezeichnete Reaktion statt, in deren Verlauf 2 weitere Protonen über die Membran transportiert werden. Von reduziertem Cytochrom c (Fe2+) werden Elektronen mit Hilfe einer Cytochromoxidase (Komplex IV; Cytochrom a3) auf molekularen Sauerstoff übertragen. Das dabei entstehende, kurzlebige und nicht faßbare O2–-Anion vereinigt sich mit Protonen zu Wasser, dem Endprodukt der Zellatmung. Charakteristisch für diese Kaskade von Redoxreaktionen ist der ständige Wechsel zwischen oxidierter und reduzierter Form der einzelnen Komponenten des Multienzymkomplexes. Die einzelnen Komponenten der Atmungskette (Atmungskettenträger) sind so hintereinandergeschaltet, daß sie bezüglich ihrer Redoxpotentiale stufenweise ein Gefälle von hoher Elektronegativität (entsprechend einer hohen Reduktionskraft von NADH) zu niedriger Elektronegativität (entsprechend dem bereits schwach elektropositiven Cytochrom a3 mit schwacher Reduktionskraft) durchlaufen. Eine Übersicht über diese schrittweise Zunahme des Redoxpotentials gibt Abb. 2 ( vgl. Abb. ), in der weitere Einzelkomponenten der Atmungskette (FeS-Pr, ein Eisen-Schwefel-Protein, die Cytochrome a, bH, bL und c) enthalten sind, die aus Gründen der Übersichtlichkeit in Abb. 1 ( vgl. Abb. ) nicht aufgeführt sind. Die Verteilung der Atmungskettenträger bezüglich der inneren mitochondrialen Membran zeigt Abb. 3 ( vgl. Abb. ). Das Multienzymsystem ist räumlich so angeordnet, daß der Kaskadenlauf der Reduktionsäquivalente (Elektronen) zugleich ein Zickzackweg innerhalb der Membran ist, in dessen Verlauf sich ein Protonen-Gradient zwischen der Innen- und Außenseite der inneren Membran ausbildet. Ein Defizit an Protonen im mitochondrialen Innenraum entsteht z. B. durch den Verbrauch von Protonen bei der NADH-Oxidation (erster Schritt der Atmungskette) und bei der Vereinigung von (1/2) O2 mit 2 Protonen (letzter Schritt der Atmungskette). Gleichzeitig werden Protonen während der Redoxreaktion des Coenzyms Q mit Cytochrom bH (aber auch durch andere, zum Teil noch hypothetische Glieder der Atmungskette) in den Außenraum (Intracristae-Raum) transportiert. Nach der von P.D. Mitchell aufgestellten Hypothese (Mitchell-Hypothese, chemiosmotische Hypothese) ist der durch die Atmungskette über der inneren Mitochondrienmembran entstehende Protonengradient zur Bildung von ATP aus ADP (Adenosin-5´-diphosphat) und Phosphat im Rahmen der Atmungskettenphosphorylierung erforderlich und gewährleistet so letztlich die Umwandlung eines hohen Anteils der durch die Zellatmung frei werdenden Energie in ATP. Durch spezifische Hemmstoffe ("Atemgifte") kann die Atmungskette an bestimmten Stellen blockiert werden, was wesentlich zur Analyse von Einzelschritten beigetragen hat. Beispielsweise hemmen Rotenon (Rotenoide), Amytal und einige Barbiturate die Übertragung von Wasserstoff von NADH auf die NADH-Dehydrogenase. Das Antibiotikum Antimycin blockiert die Weitergabe von Elektronen aus Coenzym Q auf den Cytochrom-bc1-Komplex. Cyanidionen und Kohlenmonoxid inhibieren den Elektronentransport von Cytochrom c auf die Cytochromoxidase. Als Atmungskettenentkoppler (Atmungsentkoppler) werden dagegen Stoffe bezeichnet, durch welche die Reaktionen der Atmungskette selbst zwar nicht beeinflußt werden, durch die jedoch der Aufbau eines Protonengradienten verhindert und damit der Elektronentransport von der ATP-Synthese entkoppelt wird, womit die Atmungskettenphosphorylierung gehemmt wird. In Anwesenheit von Entkopplern, zu denen unter anderem Arsenat, Dicumarol, 2,4-Dinitrophenol, Valinomycin und Thyroxin gerechnet werden, läuft die Zellatmung gleichsam im Leerlauf, also ohne Bildung von für die Zelle verwertbarer Energie in Form von ATP, ab. Schließlich gibt es auch Hemmstoffe wie die AntibiotikaOligomycin und Rutamycin, durch welche die in der Mitochondrienmembran lokalisierte ATP-Synthase (mitochondrialer Kopplungsfaktor), welche unmittelbar die ATP-Synthese katalysiert, blockiert wird. Unter physiologischen Bedingungen bzw. in intakt isolierten Mitochondrien ist die Kopplung zwischen der Atmungskette und der ATP-Synthese wechselseitig; d. h., es hängt nicht nur die ATP-Synthese vom Ablauf der Reaktionen der Atmungskette ab; vielmehr können umgekehrt auch nur dann Reduktionsäquivalente durch die Atmungskette geschleust werden, wenn eine ausreichend hohe Konzentration von ADP vorliegt bzw. wenn die ATP-Konzentration durch fortwährenden ATP-Transport (Adenylattranslokator) aus dem Mitochondrieninnenraum in die übrigen Kompartimente (Kompartimentierung) der Zelle unter einer gewissen Grenze gehalten wird. Diese "Rückkopplung" der Atmungskette an die ATP-Synthese wird als zelluläre Atmungskontrolle bezeichnet. Die durch die Atmungskette freiwerdende Energie fällt zu etwa 60% als Wärme an, während maximal 40% gebunden als ATP und in dieser Form als für den Zellstoffwechsel weiter verwertbare Energie auftreten. Die Ausbeute von ATP wird häufig durch den sog. P/O-Quotienten charakterisiert, der angibt, wieviel mol ATP pro Grammatom Sauerstoff-(1/2O2-)Verbrauch gebildet werden. Für jedes Sauerstoffatom bzw. für jeweils 2 Reduktionsäquivalente (2 H-Atome), die ausgehend von NADH die ganze Atmungskette durchlaufen, können 3 mol ATP gebildet werden (P/O-Quotient = 3). Die Wasserstoffatome von Succinat (Bernsteinsäure) werden nicht über NADH, sondern durch Übertragung auf Coenzym Q in die Atmungskette eingeschleust. Sie durchlaufen daher nur eine verkürzte Atmungskette und ermöglichen so die Synthese von nur 2 mol ATP (P/O-Quotient = 2). In Gegenwart von Entkopplern nähert sich der P/O-Quotient dem Nullwert. Winterschlafende Tiere (Winterschlaf) zeigen bei insgesamt stark verminderter Atmung einen relativ niedrigen P/O-Quotienten, wodurch eine Verschiebung zugunsten höherer Wärmeproduktion auf Kosten von ATP-Synthese erreicht wird. Aufgrund dieser natürlichen Entkopplung kommt es besonders während des Erwachens aus dem Winterschlaf im braunen Fettgewebe (braunes Fett) zu einer intensiven chemischen Thermogenese (Thermogenin, Wärmeproduktion). aerobe Atmung, Atmungsinhibitoren, Bakterien, Bakterienmembran, Blausäure, Cyanobakterien, Dehydrierung, Dehydrogenasen, Denitrifikation, Dissimilation ( Dissimilation I
Dissimilation II
), protonenmotorische Kraft, Protonenpumpe, Protonophoren, Stoffwechsel, Temperaturregulation.
H.K./M.B./J.I.
| |
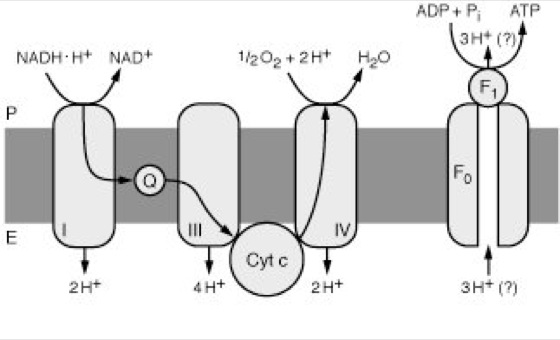
Atmungskette Abb. 3: In der Atmungskette werden durch die Redoxkomponenten Elektronen (e–) transportiert. Parallel hierzu werden Protonen nach außen abgegeben (bei Bakterien ins Medium, bei Mitochondrien in den Intracristaeraum). Dadurch bildet sich über der Membran ein pH-Gradient aus. Dieser Protonengradient ist nach der chemiosmotischen Hypothese mit der Bildung von ATP gekoppelt. Abkürzungen: I = Komplex I, III = Komplex III, IV = Komplex IV, Cyt c = Cytochrom c, Q = Coenzym Q; F1, F0 = Untereinheiten der ATP-Synthase. |
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.