Lexikon der Biologie: Aminosäuren
Aminosäuren, Aminocarbonsäuren,Carbonsäuren mit einer oder mehreren Aminogruppen, die entsprechend ihrer Position zur Carboxylgruppe als α-, β-, γ- usw. -Aminosäuren bezeichnet werden. Von wenigen Ausnahmen abgesehen, sind Aminosäuren in Wasser gut löslich und liegen in wäßrigen Lösungen zwischen pH 4 und 9 als Zwitterionen vor ( ä vgl. Abb. ). Bisher kennt man aus der belebten Natur über 260 verschiedene Aminosäuren, wobei den 20 in Proteinen vorkommenden Aminosäuren (proteinogene Aminosäuren; ä Aminosäuren ) besondere Bedeutung zukommt. Letztere sind α-Aminosäuren und besitzen am α-Kohlenstoffatom (Kohlenstoff) – mit Ausnahme von Glycin – ein asymmetrisches Zentrum mit L-Konfiguration (asymmetrisches Kohlenstoffatom). Jeder proteinogenen Aminosäure sind durch den genetischen Code mindestens ein Codon, meist jedoch mehrere Codonen zugeordnet. Dadurch kann die Sequenz der Codonen von mRNA, die letztlich durch die Nucleotidsequenz der entsprechenden Gene (Gen) bestimmt wird, in die Reihenfolge der Aminosäuren (Aminosäuresequenz) der entsprechenden Proteine übersetzt werden (Translation). Die Aktivierung der proteinogenen Aminosäuren zum Einbau in Proteine (Aminosäureaktivierung) erfolgt durch Überführung in die 20 verschiedenen Aminoacyl-Adenylsäuren und Aminoacyl-tRNAs.
Die proteinogenen Aminosäuren ( ä vgl. Tab. ) werden in neutrale Aminosäuren (keine Ladung in der Seitenkette), saure Aminosäuren (negative Ladung in der Seitenkette) und basische Aminosäuren (positive Ladung in der Seitenkette) eingeteilt( ä vgl. Tab. ). Innerhalb der neutralen Aminosäuren wird die Klasse der Aminosäuren mit hydrophiler (hydrophil) bzw. polarer (Polarität) Seitenkette (Cystein, Serin, Threonin, Tyrosin, Asparagin, Glutamin) von der Klasse der Aminosäuren mit hydrophober (hydrophob) bzw. apolarer (apolar) Seitenkette (Alanin, Glycin, Isoleucin, Leucin, Methionin, Phenylalanin, Prolin, Tryptophan, Valin) unterschieden. Phenylalanin, Tryptophan und Tyrosin werden unter dem Begriff der aromatischen Aminosäuren zusammengefaßt. Diese zeigen frei oder gebunden in Proteinen charakteristische UV-Absorption (Absorptionsspektrum) bei 280 nm und bilden damit die Grundlage zur qualitativen bzw. halbquantitativen Bestimmung von Proteinen über die Messung der UV-Absorption. – Der Nachweis einzelner freier Aminosäuren erfolgt besonders durch die Farbreaktion mit Ninhydrin. Diese Reaktion ist spezifisch für α-Aminosäuren und führt zur Bildung eines blauen Farbstoffs mit für die jeweilige Aminosäure charakteristischer Tönung. Die quantitative Bestimmung von aus Proteinhydrolysaten stammenden, komplexen Aminosäuregemischen durch den Aminosäureanalysator erfolgt mit Hilfe der Ninhydrin-Reaktion. Weitere Aminosäurereagenzien sind 2,4-Dinitrofluorbenzol und Phenylsenföl (Edmanscher Abbau). Beide werden jedoch vorzugsweise zur Identifizierung N-terminaler Aminosäuren bei der Aminosäuresequenzanalyse von Proteinen eingesetzt und haben für den Nachweis freier Aminosäuren nur begrenzte Bedeutung. – Der Mensch und Säugetiere können nicht alle proteinogenen Aminosäuren selbst aufbauen, so daß ein Teil, die Gruppe der essentiellen Aminosäuren ( ä vgl. Tab. ), durch die Nahrung aufgenommen werden muß. Die Synthese der proteinogenen Aminosäuren – bei Mensch und Tier der nicht-essentiellen Aminosäuren, bei Pflanzen und Mikroorganismen aller Aminosäuren – erfolgt durch Transaminierung der entsprechenden α-Ketosäuren ( ä vgl. Abb. ) mit Glutamat als Aminogruppen-Donor (Aminogruppe). Glutamat selbst entsteht durch direkte reduktive Aminierung von α-Ketoglutarat mit Ammoniak. Beim Abbau werden die proteinogenen Aminosäuren in einem ersten transaminierenden Schritt zu den entsprechenden α-Ketosäuren umgewandelt, wobei der Aminostickstoff auf α-Ketoglutarat unter Bildung von Glutamat übertragen wird. Letzteres kann durch dehydrierende Desaminierung unter der Wirkung von Glutamat-Dehydrogenase zu Ammoniak und α-Ketoglutarat gespalten werden. Das Gleichgewicht 
nimmt daher eine Schlüsselstellung bei Aus- und Einschleusung von Ammoniak in die Aminogruppen der Aminosäuren ein.
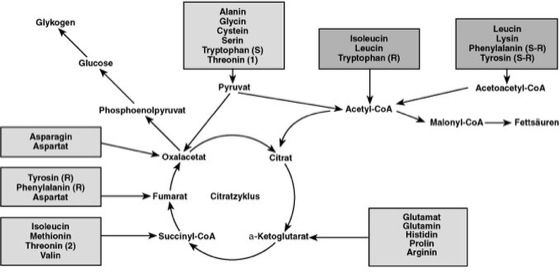
Die Aminosäuren Alanin, Aspartat und Glutamat stehen über ihre Ketosäuren (Pyruvat, Oxalacetat, α-Ketoglutarat) direkt mit dem Citratzyklus in Verbindung. Dazu gehören auch Asparagin und Glutamin, da diese durch Hydrolyse der Säureamidgruppe (Amide) in Aspartat und Glutamat übergeführt werden können. Die α-Ketosäuren weiterer Aminosäuren werden durch zusätzliche, zum Teil komplizierte Folgereaktionen in den Citratzyklus eingeschleust (ävgl. Abb.) und können über den Weg der Gluconeogenese letztlich in Kohlenhydrate (Glucose, Glykogen) umgewandelt werden. Diese Gruppe von Aminosäuren wird daher unter dem Begriff der glucogenen Aminosäuren oder glucoplastischen Aminosäuren zusammengefaßt ( ä vgl. Abb. ). Ihnen gegenüber stehen Aminosäuren, die ebenfalls in Folgereaktionen, ausgehend von den entsprechenden α-Ketosäuren, zu Acetoacetyl-Coenzym A und Acetyl-Coenzym A abgebaut werden und auf diesem Wege in Fettsäuren umgewandelt werden können. Sie können im Zuge dieser Reaktionen auch zu Ketonkörpern wie Acetoacetat (Acetessigsäure) und dessen Decarboxylierungsprodukt Aceton umgesetzt werden und werden deshalb unter dem Begriff der ketogenen Aminosäuren oder ketoplastischen Aminosäuren zusammengefaßt. – Aufgrund der Bausteine, die für die Synthese der Kohlenstoffgerüste der einzelnen Aminosäuren verwendet werden, unterscheidet man die in der Abb. dargestellten Familien (ävgl. Abb.). Diese enthalten neben den proteinogenen Aminosäuren als Endprodukte auch nichtproteinogene Aminosäuren als Zwischenprodukte (z. B. Homoserin bei den Synthesen von Isoleucin, Methionin und Threonin, Diaminopimelinsäure bei der Synthese von Lysin) oder als Folgeprodukte (z. B. Citrullin und Ornithin, die über den Harnstoffzyklus mit Arginin in Verbindung stehen). – Manche proteinogenen Aminosäuren können nach ihrem Einbau in bestimmte Proteine modifiziert werden. Zu diesen gehören z. B. Lysin, das im Fisch-Kollagen zu δ-Hydroxylysin umgewandelt wird, Tyrosin, das im Thyreoglobulin der Schilddrüse zu Triiodthyronin umgesetzt wird, und Prolin, das im Kollagen weitgehend als Hydroxyprolin vorliegt. Auch diese durch nachträgliche Modifikationen im Proteinverband entstehenden Aminosäuren werden zu den proteinogenen Aminosäuren gerechnet, wenngleich sie in der Codontabelle nicht aufgeführt werden, da ihre Codierung durch Codonen der entsprechenden unmodifizierten Aminosäuren erfolgt.
Die nichtproteinogenen Aminosäuren ( ä vgl. Tab. ) bilden mit den über 240 bisher nachgewiesenen Vertretern die zahlenmäßig größte Gruppe. Sie werden besonders zahlreich in Pflanzen gefunden. Ihre Strukturen sind sehr unterschiedlich. Die L-α-Aminoformen überwiegen, jedoch enthält z. B. das Murein-Gerüst (Murein) der bakteriellen Zellwände (Bakterienzellwand) die D-α-Aminosäuren D-Alanin und D-Glutamat, und unter den Nicht-α-Formen sind besonders das β-Alanin und die γ-Aminobuttersäure zu nennen. In vielen Fällen sind nichtproteinogene Aminosäuren Analoge von proteinogenen Aminosäuren. Niedere Homologe des Lysins sind 2,3-Diaminopropionsäure und 2,4-Diaminobuttersäure. Ein höheres Homologes von Arginin ist das Homoarginin. Auch von Prolin finden sich sowohl niedere (Acetidin-2-carbonsäure) wie höhere (Piperidin-2-carbonsäure) Homologe. Manche Strukturen unterscheiden sich von denen der proteinogenen Aminosäuren nur geringfügig durch Hydroxylierungen (Dihydroxyphenylalanin, 5-Hydroxytryptophan) oder Methylierungen (N-Methyltyrosin). Andere enthalten ungewöhnliche funktionelle Gruppen (unter anderem Ethylen-, Acetylen-, Cyclopropan-, Guanidoxy-, Diazo-Gruppen) oder ungewöhnliche heterocyclische Ringsysteme (unter anderem Furan, Pyrimidin, Isoxazolin). Vom Cystein leiten sich Formen ab, deren Schwefelatome durch Selenatome (Selen) ersetzt sind, wie im Selenocystathionin oder im Methylenoselenocystein. Viele nichtproteinogene Aminosäuren sind giftig, da sie aufgrund ihrer strukturellen Ähnlichkeit mit den proteinogenen Aminosäuren als Aminosäureantagonisten wirken und dadurch zu spezifischen Stoffwechselstörungen führen (Acetidin-2-carbonsäure). Auch der bakteriostatischen und Antitumorwirkung des Azaserins liegt ein Aminosäureantagonismus zugrunde. Einige nichtproteinogene Aminosäuren fungieren als Zwischenprodukte bei Synthese oder Abbau der proteinogenen Aminosäuren oder als Zwischenprodukte bei der Bildung von Purinen und Harnstoff. – Speziell in menschlichen und tierischen Organismen üben einige nichtproteinogene Aminosäuren spezifische Funktionen aus, wie Dihydroxyphenylalanin und 5-Hydroxytryptophan als Zwischenstufen bei der Bildung von Hormonen und γ-Aminobuttersäure als Neurotransmitter. Im Gegensatz zu diesen und anderen, jedoch insgesamt wenigen Beispielen sind die physiologischen Funktionen der meisten nichtproteinogenen Aminosäuren nicht wirklich verstanden. Neben der Schutzwirkung der giftigen nichtproteinogenen pflanzlichen Aminosäuren gegenüber Freßfeinden (pflanzliche Abwehr), die jedoch in Einzelfällen durch spezielle biochemische Mechanismen der jeweiligen Freßfeinde aufgehoben sein kann, werden vor allem Depotfunktionen in Betracht gezogen. Nichtproteinogene Aminosäuren treten in bestimmten Pflanzenfamilien gehäuft auf und eignen sich daher als taxonomische Marker. – Mehrere Aminosäuren, darunter auch die proteinogenen Aminosäuren Glycin, Alanin, Glutamat, Valin und Prolin, wurden im Innern des Murchison-Meteoriten (Meteorit) gefunden, was als Beweis für die extraterrestrische und daher wahrscheinliche abiogene Bildung von Aminosäuren angesehen wird. D-Aminosäuren, Aminosäurereagenzien, Chiralität, essentielle Nahrungsbestandteile, Fischer (E.H.), Hofmeister (F.), Knoop (F.), Leben, Loewi (O.), Miller (S.L.), Miller-Experiment, molekularer Stammbaum, Moore (S.), Proteinstoffwechsel, Rose (W.C.), Sanger-Verfahren, Sequenzstammbaum, Sørensen (S.P.L.), Stoffwechsel, Wollaston (W.H.); ä chemische und präbiologische Evolution .
H.K./M.B.
| |
Aminosäuren Abbau von Aminosäuren: Die Kohlenstoffgerüste der Aminosäuren werden umgestaltet und an verschiedenen Stellen in die Endoxidation mit einbezogen. Aus den glucogenen Aminosäuren (hellere Kästchen) ist die Netto-Kohlenhydratsynthese möglich, aus den ketogenen (dunklere Kästchen) dagegen eine Netto-Fettsäuresynthese. Für das Threonin gibt es zwei verschiedene Abbauwege (1,2), beim Tryptophan ist zwischen Ring (R) und Seitenkette (S) unterschieden, ähnlich bei Phenylalanin und Tyrosin. |
Aminosäuren
| |
| Name | Vorkommen und Funktion |
| 4-Carboxyglutaminsäure | bildet Calcium-Komplexe; in einigen Gerinnungsfaktoren, in Osteocalcin |
| Cystin (3,3´-Dithiobis-[2-aminopropionsäure]) | geht durch Reduktion leicht in Cystein über; in Haar, Keratin, Insulin |
| 3,5-Diiodtyrosin | Schilddrüsenhormon |
| Nω-Dimethylarginin | in Kernproteinen und Myelin |
| 5-Hydroxylysin (2,6-Diamino-5-hydroxyhexansäure) | in Kollagen, Bindungsstelle für Oligosaccharide |
| 4-Hydroxyprolin (4-Hydroxypyrrolidin-2-carbonsäure) | in Kollagen, Elastin, Acetylcholinesterase, frei in Pflanzen |
| 3-Hydroxyprolin (3-Hydroxypyrrolidin-2-carbonsäure) | in Kollagen |
| Nω-Methylarginin | in Kernproteinen und Myelin |
| Nτ-Methylhistidin (3-Methylhistidin) | in Muskelproteinen |
| 3-Monoiodtyrosin | Schilddrüsenhormon |
| Thyroxin (3,5,3´,5´-Tetraiodthyronin) | Schilddrüsenhormon |
| 3,3´,5´-Triiodthyronin | Schilddrüsenhormon |
| 3,5,3´-Triiodthyronin | Schilddrüsenhormon |
| N6-Trimethyllysin | in Calmodulin |
| nichtproteinogene Aminosäuren | |
| Name | Vorkommen und Funktion |
| β-Alanin (3-Aminopropionsäure) | Abbauprodukt von Pyrimidinen, Baustein von Pantothensäure bzw. Coenzym A, Carnosin und Anserin |
| α-Aminobuttersäure (2-Aminobuttersäure) | Bestandteil des Tripeptids "ophthalmic acid" in der Linse |
| γ-Aminobuttersäure (4-Aminobuttersäure) | in Hirn, Lunge, Herz; Neurotransmitter |
| δ-Aminolävulinsäure (5-Aminolävulinsäure, 4-Oxo- 5-Aminovaleriansäure) | Vorstufe bei der Porphyrinsynthese |
| Carbamoylasparaginsäure (Ureidobernsteinsäure) | Zwischenstufe bei der Pyrimidin- und Asparaginsäure-Synthese in Säugern und Bakterien |
| Citrullin (2-Amino-5-ureidovaleriansäure) | Zwischenstufe im Harnstoffzyklus |
| Ergothionein (2-Mercaptohistidinbetain) | Erythrocyten, Niere, diverse andere Gewebe, in Sperma und Mutterkorn |
| Guanidinobernsteinsäure | im Harn |
| Guanidinoessigsäure (Glykocyamin) | in Leber, Niere, Pankreas, Hirn, Vorstufe des Kreatins und des Kreatinins |
| Homoserin (2-Amino-4-hydroxybuttersäure) | Vorstufe bei Bildung von Threonin und Methionin in Mikroorganismen und Pflanzen |
| Kreatin (3-Methylguanidinoessigsäure) | Zellbestandteil im Muskel der Wirbeltiere, als Phosphat Energiespeicher |
| Nπ-Methylhistdin (1-Methylhistidin) | bildet mit β-Alanin das Dipeptid Anserin |
| Ornithin (2,5-Diaminovaleriansäure) | Zwischenprodukt im Harnstoffzyklus |
| Sarkosin (N-Methylglycin) | Zwischenprodukt bei Transfer von C1-Einheiten |
| Derivate von Aminosäuren | |
| Derivat | Vorkommen und Bedeutung |
| Acetylcholin | in tierischen Geweben; Neurotransmitter, vasodilatatorisch, senkt Blutdruck |
| Adenosylmethylthiopropylamin | an Bildung von Polyaminen, Carnitin und Kreatin beteiligt |
| Adrenalin (Epinephrin) | in Pflanzen und tierischen Geweben; Hormon, Transmitter |
| β-Alanin | in Pantothensäure bzw. Coenzym A |
| γ-Aminobuttersäure (GABA) | Neurotransmitter |
| Carnitin (4-Trimethylamino-3-hydroxy-buttersäure) | in allen tierischen Geweben; an intrazellulärem Fettstoffwechsel beteiligt |
| Cholin (2-Hydroxyethyltrimethylammoniumhydroxid) | in Pflanzen und tierischen Geweben, unter anderem in Acetylcholin, Lecithin, Plasmalogen, Sphingomyelin; Methyldonor, an Fettsäuretransport beteiligt |
| Cysteamin | in Coenzym A |
| Dopamin (3,4-Dihydroxyphenylethylamin) | in Pflanzen und tierischen Geweben, Neurotransmitter |
| Ethanolamin (Colamin) | Bestandteil von Kephalin, Plasmalogen |
| Histamin | in Pflanzen, Bakterien, tierischen Geweben; induziert Kontraktion der glatten Muskulatur, vasodilatatorisch, stimuliert Magensäuresekretion |
| 5-Hydroxytryptamin (Serotonin) | in Pflanzen und tierischen Geweben; Gewebshormon; Neurotransmitter |
| Melatonin (N-Acetyl-5-methoxytryptamin) | Epiphysenhormon; hemmt bei Säugern Gonadentätigkeit |
| 3-Methylbutylamin (Isoamylamin) | in Mutterkorn, Pfeffer, Placenta; erhöht Blutdruck, lähmt ZNS |
| Noradrenalin (Norepinephrin) | in Pflanzen und tierischen Geweben; Neurotransmitter |
| Octopamin (4-Hydroxyphenylethanolamin) | in Speicheldrüsen von Octopoden |
| Putrescin (Diaminobutan) | bakterielles Zersetzungsprodukt, in Leukocyten, Sperma, Harn |
| Spermidin | in Hefe, in fast allen tierischen Geweben, Sperma |
| Spermin | in Hefe, in fast allen tierischen Geweben, Sperma |
| Taurin | in vielen Geweben, vor allem im Hirn des Neugeborenen, möglicherweise Neurotransmitter |



Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.