Lexikon der Biologie: Cyanobakterien
Cyanobakterien [von *cyano –, griech. baktērion = Stäbchen], Oxyphotobakterien, oxygene photosynthetische Bakterien, Cyanophycota, Cyanobacteriales (Stanier, 1978), Myxophyceae (Schleimtange, Wallroth, 1833), Phycochromophyceae (Rabenhorst, 1863), Cyanophyceae (Blaualgen, Sachs, 1874), Schizophyceae (Spaltalgen, Kirchner, Cohn, 1878), Cyanobacteriota, Cyanochloronta, blaugrüne Algen,Mikroorganismen, die wie Bakterien einen prokaryotischen Zellaufbau (Prokaryoten, Protocyte) besitzen, aber eine oxygene Photosynthese durchführen, in der Sauerstoff frei wird, wie in den Chloroplasten eukaryotischer Pflanzen. Aufgrund ihres prokaryotischen Zellaufbaus und der DNA-Zusammensetzung müssen sie den Bakterien(Bacteria) zugerechnet werden (Eubakterien). Aus praktischen Gründen werden sie in botanischen taxonomischen Einteilungen manchmal noch als "prokaryotische Organisationsform" mit den eukaryotischen Algen zusammengefaßt. – Allgemeine Merkmale und Vorkommen: Es sind etwa 1500 Cyanobakterien beschrieben worden. Die Zellen sind durchschnittlich 5–10mal größer als normale Bakterienzellen. Charakteristisch sind die Phycobiliproteine, die Haupt-Antennenpigmente des Photosyntheseapparats. Cyanobakterien haben große ökologische Bedeutung im globalen Kohlenstoffkreislauf und Stickstoffkreislauf und auch in der Evolution der Pflanzen (Endosymbiontenhypothese, Evolution der Eucyte). Sie sind weltweit in Süß-, Brack- und Salzwasser sowie überall im Boden (Bodenorganismen) verbreitet (sehr selten unter sauren Bedingungen). Oft treten mit bloßem Auge sichtbare Cyanobakterien-Ansammlungen auf als gallertige Masse, fädige Überzüge, schleimige Krusten (z. B. schwarzblaue Beläge auf feuchtem Gestein), meterlange Büschel, gefärbte Wasserblüten (rote, blaue, grüne Verfärbung auf der Oberfläche oder bis ca. 2 m Tiefe), die auch als dicke schaumige Masse auf der Wasseroberfläche schwimmen können, besonders in eutrophierten Gewässern (Eutrophierung). Planktonische Cyanobakterien (Plankton) haben einen sehr hohen Anteil an der photosynthetischen Kohlendioxidfixierung, und als Primärproduzenten stehen sie oft an der Basis der Nahrungskette in marinen Habitaten. Sie haben auch erheblichen Anteil an der Primärproduktion in Binnengewässern. Es wird geschätzt, daß 20–30% der photosynthetischen Kohlendioxidfixierung durch Cyanobakterien erfolgt. Einige Formen können Kalkgestein auflösen, andere (z. B. Rivularia) Kalk in und an Scheiden ablagern. Sedimente dieser Formen bilden Seekreide und Kalktuffe im Gezeitenbereich warmer Meere, wo es auch zu Ablagerungen geschichteter Kalkkrusten (Stromatolithen) kommen kann. Besonders auffällig sind die Besiedlung und das Massenvorkommen in Grenzbiotopen – extremen Standorten, an denen sie aufgrund ihres besonderen Stoffwechsels (Photosynthese, Stickstoffixierung) und der Fähigkeit, lange größte Trockenheit (Anhydrobiose) und Kälte (Kryobiose) und sehr hohe Temperaturen zu ertragen (Anabiose), leben können ( vgl. Tab. ). Sie besiedeln Oberflächen von Felsen oder wachsen auf der Erde und auch endolithisch in Kalk- und Kreidefelsen (Hyellaceae). Man findet Cyanobakterien in heißen Quellen (bis ca. 75 °C; Hydrothermalquellen), in Salzseen (Salzgewässer), aber auch unter dem Eis in der Antarktis (Polarregion). Es gibt vielfältige Cyanobakterien-Symbiosen ( vgl. Tab. ), in denen die Cyanobakterien den Wirt hauptsächlich mit Photosynthese-Assimilaten und/oder seltener mit Stickstoff versorgen. Durch die Bindung des Luftstickstoffs spielen sie eine wichtige Rolle im Stickstoffkreislauf der Ozeane, Seen und Böden, besonders in Reisfeldern (30–50 kg N/ha pro Jahr). In Japan werden zur Ertragssteigerung Stickstoffbinder (z. B. Tolypothrix) gezüchtet und dem Wasser der Reisfelder (Reis) zugegeben. Auf ähnliche Weise wurden auch unfruchtbare Salzböden in Indien rekultiviert. Cyanobakterien sind schon bei den Azteken als Nahrung verwendet worden ("tecuitlatl", Spirulina) und dienen bei einigen Völkern (z. B. China ["Fa-Tsai"], Afrika) als normale Gemüsebeilage oder Viehfutter. Heute werden Spirulina-Arten in Großanlagen gezüchtet und als Proteinquelle z. B. in diätischer Nahrung genutzt. Zur Gewinnung von Biomasse lassen sich Cyanobakterien auch im Abwasser kultivieren. Es sind keine echten Krankheitserreger bekannt, aber einige Formen bilden hochgiftige Neurotoxine und Lebertoxine, die zu Fischvergiftungen und Viehvergiftungen führen können (z. B. Microcystis), aber auch beim Menschen Hautreizungen und nach Genuß von verunreinigtem Trinkwasser Vergiftungen verursachen können (Cyanobakterientoxine, Algengifte). Massenvorkommen von Cyanobakterien können durch Ausscheidung von Geosmin dem Trinkwasser (z. B. in Talsperren) einen erdartigen Geruch und Geschmack verleihen. – In der Wissenschaft haben Cyanobakterien große Bedeutung bei der Erforschung der Photosynthese, der N2-Fixierung, der Zelldifferenzierung und der photobiologischen Wasserstoffbildung.
Zellaufbau und Zellform: Cyanobakterien sind morphologisch sehr unterschiedlich. Sie können einzellig vorkommen oder wenig- bis vielzellige Aggregate (Coenobium, Chroococcales) in gallertigen Schleimhüllen oder Fäden (Trichome mit echter oder unechter Verzweigung) in gallertigen oder fibrillären Scheiden bilden, in denen die Zellen der Trichome untereinander plasmatisch verbunden sein können (Hormogoneae). Die Zellform ist kugelig bis stäbchen- und fadenförmig. Die Trichome können polar differenziert sein (Dermocarpa;Dermocarpaceae), meist mit einer Haftscheibe am unteren und Vermehrungszellen am oberen Ende. Auch die Zellen zeigen schon Differenzierungen. Spezialisierte Zellformen sind Überdauerungszellen (Akineten) mit dicker Zellwand, die gegen Trockenheit und Hitze resistent sind, und Heterocysten (Grenzzellen), die bei den meisten fädigen Formen die Nitrogenase zur Fixierung des Luftstickstoffs enthalten. Aber auch viele Heterocysten-freie Formen können molekularen Stickstoff (N2) binden. Die Färbung der Zellen reicht von blau-grün, grasgrün bis zu rot oder einem dunklen Braun – abhängig von ihrem Pigmentgehalt. Die bläulich-grüne Färbung der Cyanobakterien, nach der sie benannt wurden, stammt vom Phycocyanin des Photosyntheseapparats; bei den rötlichen Formen wird die Färbung durch Phycoerythrin hervorgerufen. So ist z. B. das Rote Meer nach der gelegentlich auftretenden Wasserblüte roter Oscillatoria-Arten (Oscillatoria) benannt; Oscillatoria rubens (Burgunderalge) verursacht in eutrophierten Gewässern eine rote Wasserblüte, und die Rosa-Färbung der Afrikanischen Flamingos in ostafrikanischen Sodaseen stammt von gefressenen Spirulina-Arten. – Viele Cyanobakterien führen auf fester, feuchter Oberfläche eine gleitende Bewegung aus (2–11 μm/s), manche rotieren dabei gleichzeitig um ihre Längsachse (z. B. Phormidium). Der Bewegungsmechanismus ist nur teilweise bekannt. Er beruht nicht nur auf einer einfachen Schleimausscheidung. Es gibt Hinweise, daß zumindest bei einigen Formen Heteropolysaccharid-Fibrillen im Zusammenwirken mit der normalen äußeren Schleimschicht der Zellen als treibende Kraft für eine Bewegung dienen. Diese Heteropolysaccharide, die durch spezielle Oberflächenporen ausgeschieden werden, unterscheiden sich von dem normalen Schleim ruhender Zellen. Das Cytoplasma der vegetativen Zelle ist von einer normalen Cytoplasmamembran umgeben. Im peripheren Teil des Cytoplasmas finden sich bei fast allen Cyanobakterien sackähnliche, geschlossene intracytoplasmatische Membranen, die Thylakoide, in und an denen die Komponenten des Photosyntheseapparats lokalisiert sind. Der Photosyntheseapparat ähnelt dem der eukaryotischen Pflanzen, besonders dem von Rotalgen. Unterschiede findet man im Aufbau und der Lokalisation der Thylakoide. Im Gegensatz zu den Chloroplasten der Pflanzen sind sie nicht von einer Extra-Doppelmembran umschlossen und enthalten nur Chlorophyll a und nicht Chlorophyll a und b (Chlorophylle). Die Thylakoidmembranen liegen oft parallel zur Cytoplasmamembran, sind verzweigt, gefaltet oder weisen eine komplexere Form auf; teilweise sind sie mit der Cytoplasmamembran verbunden. In der botanischen Literatur wird die durch Photosynthesepigmente gefärbte Randschicht als Chromatoplasma oder Chromoplasma und das farblose Innere als Centroplasma bezeichnet. Bei Gloeobacter fehlen Thylakoide; der Photosyntheseapparat ist in dieser Gattung in der Cytoplasmamembran lokalisiert und die Phycobiliprotein-Antennenpigmente in einer Schicht an ihrer Innenseite. – Im Innern der Zelle liegt die DNA in Grana-, Stab-, Netz- oder fädiger Form vor. Das DNA-Basenverhältnis (Guanin zu Cytosin) reicht von 35–71 mol % – eine Breite, die die großen genetischen Unterschiede innerhalb dieser Prokaryoten-Gruppe widerspiegelt. Die relative Molekülmasse des Genoms beträgt 1,6–7,6 · 109. Es ist somit im Durchschnitt deutlich größer als das der übrigen Bakterien (Bakterienchromosom, Tab.). Neben der DNA in den Kernäquivalenten (Nucleoid, auch als Chromatinapparat bezeichnet) können auch noch ringförmige Plasmide in der Zelle vorhanden sein. Die Ribosomen (Sedimentationskonstante 70 S; Sedimentation) sind diffus im Cytoplasma verteilt. Im Cytoplasma finden sich eine Reihe weiterer Einschlüsse, z. B. Reservestoffe und besonders in planktischen Formen Gasvakuolen zur Auf- und Abbewegung im Wasser ( vgl. Tab. und vgl. Abb. ). Die Zellwand (Bakterienzellwand) enthält eine Murein-Schicht (Murein) und eine äußere Membran, die Porine enthält. Ihre Feinstruktur entspricht bei einer Reihe von Arten der normaler gramnegativer Bakterien. Der Zellwand sind nach außen oft mehrere Hüllen aufgelagert ( vgl. Abb. ).
Vermehrung und Fortpflanzung: Die Vermehrung erfolgt meist durch Zweiteilung. Einige Cyanobakterien vermehren sich durch Sprossung (Exosporen; z. B. Chamaesiphon;Chamaesiphonaceae). Es können auch Vielteilungen in kleine Zellen auftreten (Nanocytenbildung). Erfolgt die Zellteilung innerhalb besonderer Zellen (Sporangien), so werden die Teilungszellen Baeocyten genannt (früher als Endosporen bezeichnet, z. B. Dermocarpa). Die Vermehrung kann auch durch kurze, bewegliche Fadenstücke (Hormogonien) erfolgen (bei Oscillatoria,Cylindrospermum), die durch Zerfall des ganzen Filaments oder an der Spitze von verzweigten Fäden gebildet werden (Scytonema; Stigonema;Stigonematales). Überdauerungsfilamente mit Reservestoffeinlagerungen (Granulabildung) und dickeren Scheiden werden als Hormocysten bezeichnet. Eine geschlechtliche Vermehrung ist bei Cyanobakterien nicht bekannt. Eine parasexuelle Übertragung (Parasexualität) von Genmaterial (z. B. Antibiotika-Resistenz) ließ sich bei einigen Arten nachweisen. – Stoffwechsel: Alle Cyanobakterien führen einen (photolithoautotrophen; Photolithotrophie) Lichtstoffwechsel aus, in dem O2 freigesetzt und CO2 im Calvin-Zyklus assimiliert wird (Photosynthese; vgl. Abb. ). Im Gegensatz zu dem der anoxygenen phototrophen Bakterien (anoxygene Photosynthese) enthält der oxygene Photosyntheseapparat der Cyanobakterien zwei Photosysteme, durch die bei Belichtung ein elektrochemischer Protonengradient (protonenmotorische Kraft), NADPH (zur Kohlendioxidfixierung) und O2 entstehen. Photosystem II (PSII) mit dem Reaktionszentrum-Chlorophyl P680 ist für die Wasserspaltung (Wasser:Plastochinon-Oxidoreductase) verantwortlich; durch Photosystem I (PSI) mit dem Reaktionszentrum-Chlorophyll P700 findet eine Reduktion von NADP+ statt (Plastocyanin: Ferredoxin-Oxidoreductase, Ferredoxin: NADP-Oxidoreductase). PSII und PSI sind durch einen linearen Elektronentransport über die Membran (über einen Cytochrom-b6f-Komplex) miteinander verbunden. Als Haupt-Antennenpigment fungieren Phycobiliproteine (Phycocyanin, Allophycocyanin, Phycoerythrin), die, zu Phycobilisomen zusammengelagert, an der Oberfläche der Thylakoidmembranen angeheftet sind. Daneben wirkt noch Bakteriochlorophyll a (Bakteriochlorophylle) als Lichtsammler. Einige Arten wachsen im Licht auch mit einfachen organischen Stoffen, z. B. Glucose oder Acetat (Photoassimilation, photoorganoheterotroph; Photoorganotrophie) oder sind befähigt, eine bakterielle (anoxygene) Photosynthese auszuführen mit H2S (Schwefelwasserstoff) oder H2 (Wasserstoff) anstelle von H2O (Wasser) als Wasserstoffdonor zur CO2-Reduktion, z. B. Oscillatoria limnetica (phototrophe Bakterien). Es gibt auch fakultativ chemotrophe Formen, die im Dunkeln z. B. mit Glucose als Energie- und Kohlenstoffquelle wachsen. Glucose wird dabei im oxidativen Pentosephosphatzyklus vollständig zu CO2 oxidiert. Da sie keinen Citratzyklus besitzen, kann Acetyl-Coenzym A nicht oxidiert werden. Die Komponenten der Atmungskette sind auf den Thylakoidmembranen lokalisiert. Es gibt auch obligat phototrophe Cyanobakterien (Phototrophie). Diese Arten besitzen gleichfalls keinen vollständigen Citratzyklus (α-Ketoglutarat-Dehydrogenase [=2-Oxoglutarat-Dehydrogenase] fehlt). Als Stickstoffquelle kann Ammonium oder Nitrat genutzt werden. Liegt kein gebundener Stickstoff vor, können viele Arten Luftstickstoff (N2) fixieren.
Fossiles Vorkommen und taxonomische Einordnung: Cyanobakterien sind uralte Organismenformen, die wahrscheinlich für die erste Anreicherung der Erd-Atmosphäre (Abb.) mit Sauerstoff verantwortlich sind (vor ca. 2,3 Milliarden Jahren), so daß die "Höheren Organismen" entstehen konnten (Leben, Abb.). Es wird angenommen, daß Cyanobakterien bzw. Cyanobakterien-Vorfahren die Vorläufer der Chloroplasten Höherer Pflanzen sind (Endosymbiontenhypothese). Die ältesten geschichteten Kalkkrusten (Stromatolithen), die auf Cyanobakterien-Ablagerungen zurückzuführen sind, lassen sich in ca. 3,5 Milliarden Jahre altem präkambrischem Gestein (Archaikum) nachweisen (Australien, Südafrika). Eindeutige, Nostoc-ähnliche (Nostoc) Cyanobakterien-Formen finden sich in der Gunflint-Iron-Formation (ca. 2 Milliarden Jahre; Gunflint-Formation, Abb.). In den Fäden (z. B. Gunflinta minuta) sind sogar Heterocysten zu erkennen, die auch auf das Vorkommen von Sauerstoff (aus der Photosynthese) schließen lassen. Heutige Stromatolithen mit Cyanobakterien, "lebende Steine" (Stromatolithen, Abb.), sind den fossilen (präkambrischen) geschichteten Kalkablagerungen in Australien, Südafrika und China sehr ähnlich. Proterozoische Erdöllager (Erdöl) werden auch auf die Aktivität von Cyanobakterien zurückgeführt. – Die Taxonomie der Cyanobakterien wirft nach wie vor viele Probleme auf und ist noch sehr unbefriedigend. So wird auch in neueren Systemen die morphologische Differenzierung noch als wichtiges Merkmal für die taxonomische Einordnung verwendet ( vgl. Tab. , vgl. Infobox ). Beispielsweise variiert das Basenverhältnis (Basenzusammensetzung, Tab.) der DNA (Guanin/Cytosin) in der chroococcalen Cyanobakteriengruppe (Ordnung Chroococcales) von 35–71 mol %. Diese Gruppe wird sicherlich noch eine starke Aufteilung erfahren. Eine verbindliche Regelung über die taxonomische Einordnung wurde auch noch nicht erreicht, so daß zur Zeit mehrere systematische Gliederungen für die Cyanobakterien bestehen ( vgl. Tab. ). Sie sind eine eigenständige Abstammungslinie in der Domäne Bacteria (Eubakterien; Archaebakterien, Abb.) – etwas näher mit der Gruppe der grampositiven als mit den gramnegativen Bakterien verwandt, obwohl ihr Zellwandaufbau dem der gramnegativen Bakterien ähnlicher ist. Einige molekulare Untersuchungen sprechen auch für eine Verwandtschaft mit den Bakterien aus der Thermus/Deinococcus-Gruppe. In der Bakteriensystematik (Bakterien, Tab.) werden die Cyanobakterien als Ordnung Cyanobacteriales zusammen mit der Ordnung Prochlorales in der Unterklasse Oxyphotobacteria (Klasse Photobacteria) eingeordnet; in einem anderen System teilt man die Cyanobakterien (ohne Rangstufe) in 5 Gruppen (oder Ordnungen) ein. Neuerdings werden auch die Prochlorophyten (Prochlorales) aufgrund molekulargenetischer Untersuchungen den Cyanobakterien als Ordnung zugerechnet; ihnen fehlen aber die für die übrigen Cyanobakterien charakteristischen Phycobiliprotein-Pigmente im Photosyntheseapparat, auch besitzen sie Chlorophyll a und b und nicht nur Chlorophyll a. Cyanophagen, Cyanophycingranula, Flechten, Zelle; Bakterien und Cyanobakterien .
G.S.
Lit.: Balows, A.: The Prokaryotes. Bde. I–IV. Berlin 21991. Bryant, D.A. (ed.): The molecular biology of Cyanobacteria. Dordrecht 1994. Carr, N.G., Whitton, B.A.: The Biology of Cyanobacteria. Oxford – London 1982. Esser, K.: Kryptogamen. Cyanobakterien, Algen, Pilze, Flechten. Praktikum und Lehrbuch. Berlin 21986. Hoiczyk, E.: Untersuchungen zur gleitenden Bewegung von Cyanobakterien. Herzogenrath 1996. Holt, J.G. et al.: Bergey's Manual of Systematic Bacteriology, Bde. I–IV. Baltimore 41984. Holt, J.G. et al.: Bergey's Manual of Determinative Bacteriology. Baltimore 91994. Madigan, M.T. et al. (Hrsg.): Brock – Biology of Microorganisms. New Jersey 92000. Margulis, L., Schwartz, Karlene V.: Die fünf Reiche der Organismen. Heidelberg 1989. Throm, G.: Biologie der Kryptogamen. Band I: Bakterien – Pilze – Flechten. Frankfurt 1997.
| |
| 1 Cyanobakterien | |
 | |
| 2 | |
 | |
| 3 | |
1 Schematischer Aufbau einer vegetativen Cyanobakterien-Zelle: Ca Carboxisom, CG Cyanophycingranulum, GG Glykogengranulum, GV Gasvesikel, IM intracytoplasmatische Membranen (Thylakoide), MP Mikroplasmodesmen, PB Phycobilisomen, PP Polyphosphate, 70S-R = 70S-Ribosomen. 2 und 3 Elektronenmikroskopische Aufnahmen von Cyanobakterien: 2 Ausschnitt eines Dünnschnitts von Synechocystis; 3 Aufnahme in Gefrierbruchtechnik (Microcystis aeruginosa), Gv Gasvesikel, Tm Thylakoidmembranen. |
| |
| 1 | |
 | |
| 2 | |
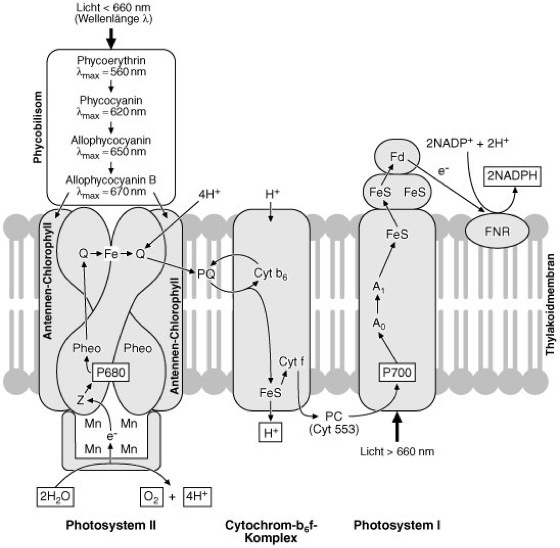
Cyanobakterien Abb. 1: Schema der Photosynthese bei Cyanobakterien Der oxygene Photosyntheseapparat ist (außer bei Gloeobacter) in und an intracytoplasmatischen Membranen (Thylakoiden) lokalisiert. Er enthält zwei Photosysteme (PSI und PSII). Der phototrophe Energiegewinn verläuft wie bei der Photosynthese von Pflanzen mit zwei Lichtreaktionen und einer Wasserspaltung unter Freisetzung von molekularem Sauerstoff (O2). Im PSII liegen das Reaktionszentrum-Chlorophyll P680 (Chlorophyll a), ein Heterodimer, das als Wasser:Plastochinon-Oxidoreductase fungiert, die Antennenpigmente, Chlorophyll a (nicht a und b wie in Höheren Pflanzen) sowie Carotinoide, Phäophytin a (Pheo) und zwei Chinone (Q) mit einem Eisen dazwischen (Fe). Weitere, spezifische Antennenpigmente, die Phycobiliproteine (Phycocyanin, Allophycocyanin und seltener Phycoerythrin), sind in Phycobilisomen an der Membranaußenseite angelagert. Die Antennenpigmente leiten die Anregungsenergie des Lichts auf das P680 weiter und passen sich quantitativ und oft auch qualitativ an die Lichtverhältnisse an (chromatische Adaptation). Das wasserspaltende System von PSII liegt an der Innenseite der Membran mit einem Mangan-Cluster verbunden. Die Elektronen werden über den ersten Akzeptor Z, das Phäophytin, auf die Chinone und den Plastochinonpool (PQ), der in der Membran liegt, geleitet. PSII ist mit dem PSI durch einen Cytochrom-b6f-Komplex verbunden, der auch zum Aufbau des Protonengradienten über die Membran beiträgt. Plastocyanin (PC) oder Cytochrom-553, die als Elektronendonoren für PSI fungieren, nehmen die Elektronen vom Cytochromkomplex auf. Das PSI (P700) fungiert als Plastocyanin:Ferredoxin-Oxidoreductase. Die Elektronen werden über mehrere Komponenten, den primären Akzeptor (A0), Chinon (A1), Eisen-Schwefel-Cluster (FeS), schließlich auf Ferredoxin (Fd) übertragen. Durch die membrangebundene Ferredoxin:NADPöOxidoreductase (FNR) wird schließlich NADPH gebildet. – Während des lichtgetriebenen (nicht-zyklischen) Elektronentransports wird über die Thylakoidmembran ein Protonengradient ausgebildet, der für energieabhängige Reaktionen der Zelle genutzt wird, z. B. zur Bildung von ATP für die Assimilation von Kohlendioxid. Früher wurde diese Art der ATP-Bildung auch als nicht-zyklische Photophosphorylierung bezeichnet. – Einige Cyanobakterien (z. B. Oscillatoria limnetica) können auch unter anaeroben Bedingungen eine bakterielle (anoxygene) Photosynthese (nur PSI) mit einem zyklischen Elektronentransport ausführen und Schwefelwasserstoff (H2S) oder molekularen Wasserstoff (H2) als Elektronendonor zur Bildung von Reduktionsäquivalenten verwerten. Abb. 2: Schema des Kohlenstoff-Stoffwechsels bei Cyanobakterien (Breite, nicht gerasterte Pfeile: Reaktionen des Photosynthesestoffwechsels, Breite, gerasterte Pfeile: Reaktionen des Dunkelstoffwechsels) Im Licht wird Kohlendioxid (CO2) im Calvin-Zyklus assimiliert und im reduktiven Pentosephosphatzyklus in Kohlenhydrate (z. B. für Zellwandkomponenten und Glykogen) umgewandelt. Im endogenen Dunkelstoffwechsel (Erhaltungsstoffwechsel) werden die Speicherstoffe (z. B. Glykogen) im oxidativen Pentosephosphatweg abgebaut, das entstehende NADPH über die Atmungskette mit molekularem Sauerstoff oxidiert und dabei Energie (ATP) gewonnen. In gleicher Weise verläuft der Energiegewinn bei den Arten, die im Dunkeln auch Glucose als exogenes Substrat verwerten können. |
Cyanobakterien
Membrankomponenten
der Cyanobakterien:
Lipide
Glykolipide
(Monogalactosylglyceride,
Digalactosylglyceride)
Phospholipide
(Phosphatidyldiglyceride)
2-Methylhopanoide
Photochemisch aktives
Pigment
(Reaktionszentrum-
Chlorophyll)
Chlorophyll a
Antennenpigmente
Chlorophyll a
Carotinoide (β-Carotin, Zeaxanthin, Echinone, Myxoxanthophyll)
Antennenpigment-Komplexe
Chlorophyll-a-Antennenkomplex
(Photosystem I)
Phycobilisomen mit
Phycocyanin,
Allophycocyanin,
Phycoerythrin (nur im
Photosystem II)


Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.