Lexikon der Biologie: Sequenzierung
Sequenzierungw [von *sequenz- ; Verb sequenzieren], Sequenzanalyse, die Ermittlung der Reihenfolge (Sequenz; Primärstruktur) der Bausteine bei den schriftartig aufgebauten Makromolekülen (Biopolymere) DNA, RNA (Basensequenz, Nucleotidsequenz) und Proteine (Aminosäuresequenz). Historisch begann die Entwicklung von Methoden zur Sequenzanalyse ( vgl. Infobox 1 ) mit der Sequenzierung von Insulin (F. Sanger, 1953). Heute wird die Sequenzierung von Proteinen automatisch mit Hilfe von Protein-Sequenatoren durchgeführt (Proteine). In den 1960er Jahren folgte – ebenfalls durch F. Sanger – die Entwicklung von Methoden zur Sequenzierung von Ribonucleinsäuren, die besonders auf Fingerprint-Analyse (DNA-fingerprinting) von Oligonucleotiden basieren. Seit Ende der 1970er Jahre werden jedoch zunehmend basenspezifische Abbaureaktionen terminal markierter (Markierung) RNAs (ähnlich wie bei der Sequenzierung von DNA) angewandt. Für die Sequenzierung von Desoxyribonucleinsäuren wurden Mitte der 1970er Jahre 2 Methoden von A. Maxam und W. Gilbert sowie wiederum von F. Sanger entwickelt. Die Maxam-Gilbert-Methode (chemische Methode der DNA-Sequenzierung) verwendet 4 basenspezifische Abbaureaktionen ( vgl. Infobox 2 ) von 5'- oder 3'-terminal radioaktiv markierten DNA-Fragmenten, die man durch Spaltung klonierter DNA mit Restriktionsenzymen und anschließende terminale radioaktive Markierung (Marker) erhält. Nach limitierter Einwirkung der 4 Abbaureaktionen auf das zu sequenzierende terminal markierte DNA-Fragment werden die entstehenden Gemische von Abbauprodukten durch Gelelektrophorese aufgetrennt. Das durch anschließende Autoradiographie erkennbare Fragmentmuster erlaubt eine direkte Ableitung der Nucleotidsequenz. Die von F. Sanger entwickelte Methode (enzymatische Methode der DNA-Sequenzierung; Sanger-Verfahren) bedient sich der vier 2',3'-Didesoxynucleosid-5'-triphosphate (daher die Bezeichnung Didesoxymethode;Desoxyribonucleoside; vgl. Abb. 1 ), die in 4 getrennten Reaktionen zur Termination von DNA-Polymerase-katalysierten Reaktionen (DNA-Polymerasen) führen, da wegen der fehlenden 3'-Hydroxylgruppen eine Fortsetzung der DNA-Synthese an einmal eingebauten 2',3'-Didesoxynucleosid-Resten nicht möglich ist. Um eine nur partielle Terminierung zu erreichen, werden auch die normalen 2'-Desoxynucleosid-5'-triphosphate in allen 4 Reaktionen in sorgfältig abgestimmten Konzentrationen beigemischt. In den 4 (im Gegensatz zur Maxam-Gilbert-Methode) aufbauenden Reaktionsansätzen resultieren schließlich Gemische von G-, A-, C- bzw. T-terminierten Elongationsprodukten (Elongation) eines an einer definierten Stelle der zu sequenzierenden DNA startenden primers. Durch Zugabe eines der 2'-Desoxynucleosid-5'-triphosphat-Bausteine bzw. des primers in radioaktiver Form werden die Elongationsprodukte markiert. Sie ergeben nach gelelektrophoretischer Auftrennung und Autoradiographie ( vgl. Abb. 2 ) ein Bandenmuster, das wiederum die direkte Ableitung ihrer Nucleotidsequenz erlaubt. Sie ist zu der als template (Matrize) wirkenden, eigentlich zu sequenzierenden DNA komplementär (Komplementarität), weshalb die Nucleotidsequenz der letzteren durch die Basenpaarungsregeln (Basenpaarung) abgeleitet werden kann. Als Vektor dient entweder DNA des Bakteriophagen M13 (Bakteriophagen), da diese einzelsträngig (einzelsträngige DNA-Phagen) leicht isolierbar und mit einem primer gut hybridisierbar (Hybridisierung) ist (M13-Methode), oder aber DNA von Plasmiden. Auch PCR-Produkte (Polymerase-Kettenreaktion) können als template zur Sequenzermittlung dienen. An die beiden letzteren wird jedoch erst nach Denaturierung ihrer Doppelstränge eine Anhybridisierung der primer ermöglicht. Plasmide und PCR-Produkte bieten allerdings den Vorteil, daß sie in beide Richtungen sequenziert werden können. Anstelle der radioaktiven Markierung von Elongationsprodukten werden heute meist Fluoreszenzfarbstoffe (Fluorochrome) verwendet, wodurch eine Auswertung der Sequenzen mit Hilfe von Sequenzierautomaten (DNA-Sequenzer) ermöglicht wird. Neben fluoreszenzmarkierten primern kommen auch fluoreszenzmarkierte 2',3'-Didesoxynucleosid-Reste zum Einsatz. Sind dabei an die 4 verwendeten Terminatoren in unterschiedlichen Wellenlängenbereichen fluoreszierende Farbstoffe gekoppelt (z.B. BigDye-Terminatoren oder DYEnamic-Terminatoren), können alle 4 Terminationsreaktionen in einem Ansatz ablaufen. Aus dem nach gelelektrophoretischer Auftrennung erhaltenen Bandenmuster ist die Sequenzabfolge anhand der unterschiedlichen Fluoreszenzfärbung der 4 Terminationsprodukte einfach zu ermitteln. Annotierung, Biochemie (Geschichte der), Bioinformatik, Biophysik, Cycle-Sequencing, DNA-Synthesizer, Gasphasen-Sequenator, Genbibliothek, Genomik, Genomprojekt, Gentechnologie, Oligonucleotidsynthese, primer walking, Proteomik, Sequenz-alignment, Sequenzraum, Sequenzstammbaum, shotgun-Sequenzierung, statistische Geometrie.
H.K./R.M.
Sequenzierung
I.DNA-Sequenzierung
Die Sequenzierung von Desoxyribonucleinsäuren, heute eine der am meisten angewandten molekularbiologischen Methoden, hat seit Einführung der beiden grundlegenden Verfahren durch A. Maxam und W. Gilbert (basenspezifischer Abbau; Maxam-Gilbert-Methode) bzw. F. Sanger (basenspezifischer Kettenabbruch durch Didesoxynucleotide; Sanger-Verfahren) gegen Ende der 1970er Jahre bedeutende Weiterentwicklungen erfahren. Diese beruhen vor allem auf Automatisierung einzelner Arbeitsschritte, alternativen Markierungs- und Detektionsmethoden sowie der PCR-Technik (Polymerase-Kettenreaktion).
1. Fluoreszenz-Sequenzierung
Bei dieser modifizierten Didesoxymethode werden zur Markierung von DNA-Fragmenten (Endmarkierung von DNA-Fragmenten) anstelle radioaktiver Isotope Fluoreszenzfarbstoffe (Fluoreszenz, Fluorochrome) verwendet. Diese sind kovalent an den verwendeten Sequenzierungs-primer gebunden. Alternativ können jedoch auch fluoreszenzmarkierte Desoxynucleotide zur Kettenverlängerung (Elongation) oder fluoreszenzmarkierte Didesoxynucleotide zum Kettenabbruch (Termination) eingesetzt werden. Mit Hilfe eines sog. Laser-Fluoreszenz-DNA-Sequenators (DNA-Sequenzer; vgl. Abb. 3 ) werden die Farbstoffe im Verlauf der Elektrophorese an einer definierten Position im Sequenzgel bzw. an den zur Auftrennung der Terminationsprodukte verwendeten Kapillaren durch das Licht eines Laserstrahls (Laser) angeregt (Anregung) und das emittierte Fluoreszenzlicht durch spezielle Detektoren registriert. Die sequenzspezifischen Signale werden an einen Computer weitergeleitet, verrechnet und nahezu gleichzeitig („on-line“) am Monitor graphisch dargestellt bzw. auf einem Datenträger gespeichert. Zusammen mit der graphischen Darstellung wird vom Rechner auch direkt die Nucleotidsequenz im Datenbank-kompatiblen Format angegeben. Der Vorteil dieser Methode liegt neben dem Verzicht auf radioaktive Isotope vor allem darin, daß die bei konventioneller Sequenzierung notwendige Autoradiographie sowie die manuelle Auswertung des Films entfallen. Die Sequenzdaten können bereits während der gelelektrophoretischen Auftrennung (Gelelektrophorese) registriert werden.
2. Multiplex-Sequenzierung
Diese Methode ermöglicht die gleichzeitige Sequenzierung von bis zu 50 verschiedenen DNA-Fragmenten. Jedes dieser Fragmente wird zuvor in einen unterschiedlichen Plasmid-Vektor einkloniert. Die Vektoren unterscheiden sich dadurch, daß sie flankierend zur Klonierungsstelle vektorspezifische Oligonucleotidsequenzen (Oligonucleotide) aufweisen. Die zu sequenzierenden Fragmente werden mit geeigneten Restriktionsenzymen einschließlich der nun fragmentspezifischen Oligonucleotidsequenzen aus den Vektoren ausgeschnitten und im Gemisch nach dem Prinzip der chemischen Methode sequenziert. Die entstehenden Spaltprodukte werden gelelektrophoretisch aufgetrennt und auf einen Membranfilter übertragen (geblottet; blotting-Techniken). Die Sequenz eines Fragments kann nach Hybridisierung mit einer markierten Oligonucleotid-Sonde, deren Sequenz komplementär zu dem fragmentspezifischen DNA-Bereich ist, dargestellt werden. Nach Abwaschen der Sonde und Hybridisierung mit einer weiteren, für ein anderes DNA-Fragment spezifischen Sonde können nach und nach anhand der gleichen Membran alle weiteren Sequenzen sichtbar gemacht werden. Die Methode bietet den Vorteil, daß die basenspezifischen Spaltreaktionen und die anschließende gelelektrophoretische Auftrennung nur ein einziges Mal für bis zu 50 zu sequenzierende DNA-Fragmente durchgeführt werden müssen.
3. Zyklische Sequenzierung
Die zyklische Sequenzierung stellt eine Kombination der Didesoxymethode und der Polymerase-Kettenreaktion (PCR) dar. 4 verschiedene Reaktionsansätze, die neben der zu sequenzierenden DNA, einem für diese Sequenz spezifischen primer, Desoxynucleosidtriphosphaten und einer thermostabilen DNA-Polymerase je eines der 4 Didesoxynucleosidtriphosphate (ddATP, ddCTP, ddGTP, ddTTP; Desoxyribonucleoside) in geeigneter Konzentration enthalten, werden ähnlich der PCR-Reaktion einer Folge automatisierter Denaturierungs-, Hybridisierungs- und Polymerisationsschritte unterworfen. Nach ca. 50 Zyklen werden die Reaktionen gestoppt und die in den Reaktionsansätzen enthaltenen sequenzspezifischen DNA-Fragmente gelelektrophoretisch aufgetrennt. Zur Markierung können fluoreszierende primer eingesetzt werden. Werden mit 4 unterschiedlichen Fluoreszenzfarbstoffen gekoppelte Didesoxynucleosidtriphosphate verwendet, können alle 4 Terminationsreaktionen in einem Ansatz durchgeführt werden. Die Sequenzen können dann mit Hilfe eines DNA-Sequenzers ausgewertet werden.
II. RNA-Sequenzierung
Die hauptsächlich angewandte Methode zur Sequenzierung von Ribonucleinsäuren gleicht in ihrem Prinzip in etwa der chemischen Methode zur Ermittlung von DNA-Sequenzen. Durch basenspezifische chemische Spaltung radioaktiv markierter RNA-Moleküle werden verschiedene Sets an RNA-Fragmenten erzeugt, die in hochauflösenden Polyacrylamidgelen aufgetrennt und durch anschließende Autoradiographie sichtbar gemacht werden können. Heute werden zur sequenzspezifischen Fragmentierung von RNA-Molekülen meist basenspezifisch spaltende Ribonucleasen eingesetzt. Nach reverser Transkription von RNA und anschließender Sequenzierung der cDNA ist es auch auf indirektem Wege möglich, zu Sequenzdaten von RNA-Molekülen zu gelangen.
III. Protein-Sequenzierung
Die Sequenzierung von Proteinen wird heute automatisiert mittels sog. Protein-Sequenatoren nach dem Prinzip des Edmanschen Abbaus durchgeführt (Proteine). Neben Flüssigphasen-Sequenatoren werden auch Gasphasen-Sequenatoren eingesetzt. Letztere benötigen lediglich 20–100 Picomol Protein für eine Sequenzauflösung von bis zu 50 Aminosäuren. Mittels Massenspektrometrie können heute sogar Proteinmengen im Bereich von 1 Picomol mit einer Auflösung von etwa 20–30 Aminosäuren analysiert werden.
Genom-Sequenzierung
„Even the smallest functional DNA varieties seen, those occurring in certain small phages, must contain something like 5000 nucleotides in a row. We may, therefore, leave the task of reading the complete sequence of a DNA to the 21st century which will, however, have other worries.“ (E. Chargaff, 1968).
Dieses Zitat zeigt, wie skeptisch man noch Ende der 1960er Jahre der Möglichkeit, ganze Genome sequenzieren zu können, gegenüberstand. Keine 10 Jahre später konnte die Sequenz eines Phagengenoms (Bakteriophage ΦX174) mit über 5000 Nucleotiden Länge veröffentlicht werden ( vgl. Tab. ). Vor allem die Entwicklung der Didesoxymethode durch F. Sanger sowie der chemischen Sequenzierungsmethode durch A. Maxam und W. Gilbert gegen Ende der 1970er Jahre ermöglichte es, daß auch weitaus größere Genome sequenziert werden konnten. Bis Ende 2002 wurden über 28 Milliarden Nucleotide sequenziert und in Datenbanken, wie z.B. der EMBL-Datenbank (EMBO) in Europa, der DDBJ-Datenbank in Japan und der NCBI-GenBank in den USA, gespeichert. Ende 1992 waren es noch ca. 120 Millionen, Ende 1982 ca. 680.000 Nucleotide. Bis Ende 2002 waren die vollständigen Genomsequenzen von über 1000 Viren, über 100 Bakterien sowie mehrerer einzelliger und mehrzelliger Eukaryoten ermittelt, darunter die der ModellorganismenEscherichia coli (1997), Caenorhabditis elegans (1998), Drosophila melanogaster (2000), Arabidopsis thaliana (Acker-Schmalwand; Arabidopsis-Genom-Projekt; 2000) und der Hausmaus (Mus musculus; 2002) (Genomprojekt [Tab.]). Die in den großen Datenbanken (EMBL, DDBJ und GenBank; Bioinformatik) gesammelten Sequenzen sind über Datennetze weltweit in den einzelnen Forschungseinrichtungen abrufbar und stehen der Wissenschaftswelt für weitere Analysen frei zur Verfügung. Neu erhaltene Sequenzen können z.B. durch ein sog. Sequenz-alignment (die optimale Ausrichtung einzelner Sequenzen zueinander, bis maximale Übereinstimmung erreicht ist, wobei Deletionen bzw. Insertionen erlaubt sind) mit in den Datenbanken bereits gespeicherten Sequenzen nach Übereinstimmungen untersucht werden. Auf diese Weise können z.B. Aussagen über stammesgeschichtlich und/oder funktionell verwandtschaftliche Beziehungen einzelner Sequenzen zueinander gewonnen werden (Sequenzstammbaum).
R.M.;
Sequenzierung
Marksteine der DNA-Sequenzierung
| |||
| 1968 | Bakteriophage-Lambda-Enden | 12 Nucleotide | |
| 1973 | Bakteriophage ΦX174-Fragmente | ca. 50 Nucleotide | |
| 1977 | Bakteriophage ΦX174-Genom | 5375 Nucleotide | |
| 1981 | menschl. Mitochondrien-Genom | 16.569 Nucleotide | |
| 1982 | Bakteriophage-Lambda-Genom | 48.502 Nucleotide | |
| 1984 | Epstein-Barr-Virus-(EBV-)Genom | 172.282 Nucleotide | |
| 1990 | Human Cytomegalo-Virus-(HCMV-)Genom | 229.354 Nucleotide | |
| 1992 | Hefe-Chromosom III | 315.356 Nucleotide | |
| 1995 | Haemophilus influenzae-Genom | 1,83·106 Nucleotide | |
| 1996 | Methanococcus jannaschii-Genom | 1,67·106 Nucleotide | |
| 1996 | Saccharomyces cerevisiae-Genom | 12·106 Nucleotide | |
| 1997 | Escherichia coli-Genom | 4,64·106 Nucleotide | |
| 1998 | Caenorhabiditis elegans-Genom | 97·106 Nucleotide | |
| 2000 | Drosophila melanogaster-Genom | 116·106 Nucleotide | |
| 2000 | Arabidopsis thaliana-Genom | 115·106 Nucleotide | |
| 2001 | menschliches Genom | 2,7·109 Nucleotide |
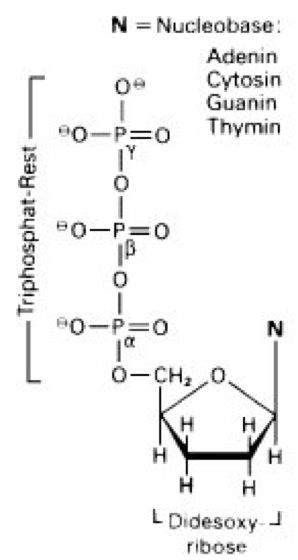
Sequenzierung
Abb. 1: Strukturformel der bei der Sequenzierung nach F. Sanger eingesetzten 2',3'-Didesoxynucleosid-5'-triphosphate. Um die von der DNA-Polymerase katalysierte primer-abhängige Reaktion spezifisch an den G-Resten zu unterbrechen, wird 2',3'-Didesoxyguanosin-5'-triphosphat (N = Guanin) eingesetzt. Die entsprechenden 2',3'-Didesoxynucleosid-5'-triphosphate bei den 3 anderen Reaktionen enthalten N = Adenin (A-spezifische Terminierung), N = Cytosin (C-spezifische Terminierung) bzw. N = Thymin (T-spezifische Terminierung).
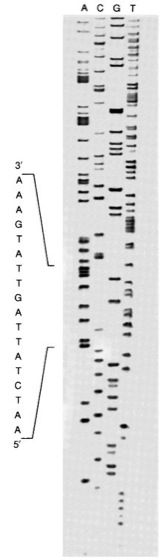
Sequenzierung
Abb. 2: Autoradiogramm radioaktiv-markierter, nach der Didesoxy-Methode sequenzierter DNA
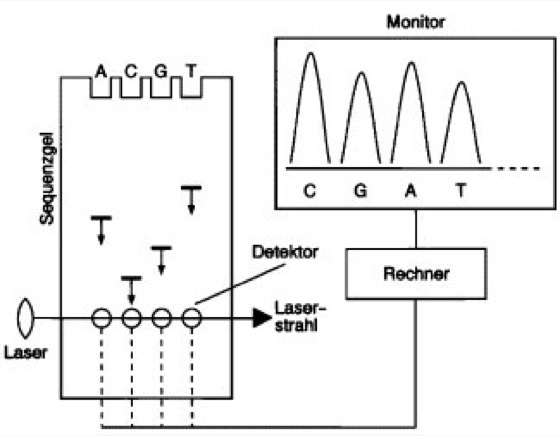
Sequenzierung
Abb. 3:Laser-Fluoreszenz-DNA-Sequenator:
Die nach der Didesoxymethode entstehenden 4 Reaktionsansätze (A, C, G, T) mit sequenzspezifischen fluoreszenzmarkierten DNA-Fragmenten werden im Verlauf der Elektrophorese ihrer Länge entsprechend zeitlich versetzt von speziellen Photodetektoren registriert. Je ein Detektor ist im Bereich des durch das Gel weisenden Laserstrahls hinter jeder Gelspur angebracht. Durch das Licht des Lasers wird der Fluoreszenzfarbstoff zur Emission von Licht angeregt. Die sequenzspezifischen Signale werden an einen Rechner weitergegeben, ausgewertet und „on-line“ am Monitor dargestellt. Alternativ zur dargestellten Form können durch 4 verschiedene Farbstoffe markierte Terminationsprodukte in einer einzigen Gelspur aufgetrennt werden. Anstelle von Gelen können zur Auftrennung auch Kapillaren verwendet werden.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.