Lexikon der Neurowissenschaft: Netzhaut
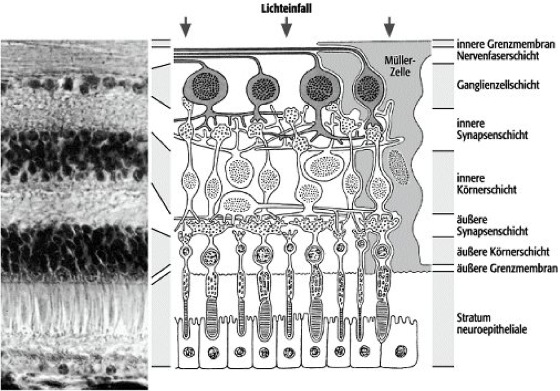
Netzhaut w, Retina, innere Augenhaut, Tunica oculi interna,E retina, ein 0,2 bis 0,5 mm dickes, aus mehreren Schichten aufgebautes Häutchen, das die Innenfläche des hinteren Augenballs des Linsenauges auskleidet ( siehe Abb. 1 ). Sie ist das Sinnesepithel des Gesichtssinns. Entwicklungsgeschichtlich ist sie ein Abkömmling des Diencephalons. Die Netzhaut ist derjenige Teil des Auges, in dem Licht in neuronale Aktivität verwandelt und in vorverarbeiteter Form dem Thalamus, dem Mesencephalon und einigen anderen Kerngebieten zugeleitet wird. Sie dient nicht nur der Reizaufnahme, in ihr findet auch schon eine komplexe Reizverarbeitung statt. Dies ist sofort erkennbar an der drastischen Konvergenz der Leitungsbahnen: in der menschliche Netzhaut wird die Aktivität von über 130 Mio. Photorezeptorzellen auf die Aktivität von nur etwa 1 Mio. Ganglienzellen abgebildet. – Die Netzhaut der Wirbeltiere ( siehe Abb. 2 ) wird aus zwei übereinander liegenden Schichten des Augenbechers gebildet, von denen das innere Blatt Stratum cerebrale (Stratum nervosum retinae), das äußere Blatt Stratum pigmenti (Stratum pigmentosum retinae) genannt wird. Das Stratum pigmentosum besteht aus einem einschichtigen Epithel und überzieht auch die inneren Flächen des Ciliarkörpers und der Iris. Das Stratum nervosum wird seinerseits in 9 Schichten unterteilt: 1) Als Stratum neuroepitheliale bezeichnet man die Außen- und Innensegmente der Photorezeptoren. In den Wirbeltieren liegen die Teile der Photorezeptoren, in denen Lichtenergie absorbiert und in intrazelluläre Signale umgesetzt wird, an der Außenseite der Netzhaut und werden von den Photonen erst erreicht, nachdem sie die Netzhaut passiert haben (inverses Auge). 2) Die äußere limitierende Membran (äußere Grenzmembran, Stratum limitans externum) befindet sich am Übergang des Myoids in die Außenfaser der Stäbchen bzw. Zapfensomata. Sie wird durch Zonulae adhaerentes zwischen den Müller-Zellen und dem Innensegment von Stäbchen und Zapfen gebildet. 3) Die äußere Körnerschicht (Stratum nucleare externum) wird von den Zellkörpern der Stäbchen und Zapfen gebildet. 4) Die äußere Synapsenschicht (äußere plexiforme Schicht, Stratum plexiforme externum) enthält in ihrem äußeren Bereich die Axone der Zapfen und Stäbchen, in ihrem mittleren Bereich die Endknöpfe der Stäbchen und die Endkolben der Zapfen und in ihrem inneren Bereich die verzweigten Fortsätze der Bipolar- und Horizontalzellen. Die Endkolben der Zapfen bilden invaginierende Zellkontakte in Form von sogenannten Triaden sowie flache synaptische Kontakte mit anderen Zapfen oder Stäbchen. Die Endknöpfe der Stäbchen bilden vorwiegend invaginierte Synapsen. 5) Die innere Körnerschicht (Stratum nucleare internum) enthält die Zellkörper der Horizontal-, Bipolar-, Müller-, Amakrin- und Interplexiform-Zellen. 6) Die innere Synapsenschicht (innere plexiforme Schicht, Stratum plexiforme internum) wird aus Fortsätzen der Amakrin-, Bipolar- und Ganglienzellen gebildet, die dort untereinander viele Synapsen bilden. 7) Die Ganglienzellschicht (Stratum ganglionare) enthält die Zellkörper von Ganglienzellen und dysplazierten Amakrinzellen. 8) In der Nervenfaserschicht (Stratum neurofibrarum) sammeln sich die Axone der Ganglienzellen, verlaufen in radialer Richtung zum blinden Fleck und bündeln sich dort zum Opticus, der durch die Netzhaut hindurchtritt und das Auge verläßt. An der Stelle des Austritts des Sehnervs aus dem Auge können sich deshalb keine Photorezeptoren befinden ( siehe Abb. 3 ). 9) Die innere limitierende Membran (innere Grenzmembran, Stratum limitans internum) besteht aus den Endfüßchen von Müller-Zellen und Astrocyten sowie aus einer Basalmembran. An die innere limitierende Membran schließt der Glaskörper des Auges an. – Bei einigen Invertebraten, z.B. dem Tintenfisch, der wie die Wirbeltiere ein hochentwickeltes Linsenauge hat, liegen die Schichten des Stratum nervosum gerade in umgekehrter Reihenfolge vor; hier liegen die lichtabsorbierenden Zellen auf der dem Licht zugewandten Seite der Netzhaut (everses Auge). – Die Netzhaut ist aus verschiedenen physiologisch und morphologisch unterscheidbaren Zelltypen aufgebaut ( siehe Abb. 4 ). Im Auge der meisten Wirbeltiere gibt es zwei Typen von Photorezeptorzellen: die Stäbchen für das Sehen bei schwachem Licht (Dämmerung bis Sternenhimmel) und die Zapfen für das Tages- und Farbensehen. Die Photorezeptoren geben ihren durch den Lichteinfall modulierten Erregungszustand an die primären sensorischen Neurone, die Bipolarzellen, weiter, die ihrerseits Signale an die sekundären sensorischen Neurone, die retinalen Ganglienzellen, mitteilen. Die Axone der Ganglienzellen verlassen das Auge über den Sehnerv (Opticus). – Die Horizontalzellen bilden Quervernetzungen auf Höhe der äußeren plexiformen Schicht. Man unterscheidet zwei Typen von Horizontalzellen: die Axone der H I-Zellen sind mit den Endknöpfchen der Stäbchen verbunden, die Axone der H II-Zellen bilden Kontakte mit den Zapfenendkolben. Amakrinzellen bilden Quervernetzungen auf Höhe der inneren plexiformen Schicht. Amakrinzellen sind Interneurone ohne ein typisches Axon, die synaptische Kontakte mit Bipolarzellen und Ganglienzellen eingehen. Die Müller-Zellen sind radiäre Gliazellen, die sich von der inneren bis zur äußeren limitierenden Membran erstrecken. Ihre Aufgaben liegen u.a. in der mechanischen Stützung der Netzhaut und in der Regulation des Elektrolythaushalts im Extrazellularraum. – Die Verteilung des Rezeptor- und Nervenzellmosaiks in der menschlichen Netzhaut ist das Resultat evolutionärer Prozesse, die die Verwertung visueller Reize über einen weiten Bereich von Reizbedingungen optimiert haben. Die Netzhaut der Säuger weist eine spezialisierte Zone hoher Rezeptorzelldichte auf. Die Zone kann unterschiedliche Formen annehmen. Im Kaninchen sind die Rezeptoren entlang einem horizontalen Streifen, dem "visual streak", besonders dicht angeordnet. In der Ratte findet man einen Bereich höherer Rezeptordichte im Bereich des zentralen Sehens. Bei Primaten ist der Bereich des zentralen Sehens sehr viel deutlicher ausgeprägt und bildet wegen der extrem hohen Zelldichte eine grubenartige Verformung der Netzhaut, die Fovea centralis. Die hohe visuelle Auflösung von etwa 30 Bogensekunden beim Menschen wird nur im Bereich des zentralen (fovealen) Sehens erreicht. Diese topographische Spezialisierung der Netzhaut ist notwendig, um einen guten Kompromiß zwischen maximaler visueller Auflösung und ökonomischem Einsatz der Signalverarbeitungsresourcen des Gehirns zu erzielen. Bliebe die Dichte von Rezeptoren und Neuronen auch außerhalb der Fovea unverändert hoch, dann müßte die zur Verarbeitung dieser Informationsflut notwendige Großhirnrinde bei Primaten etwa 100 mal größer sein als ihr gesamtes Gehirn tatsächlich aufweist. Mit Hilfe des okulomotorischen Systems wird immer nur der gerade wichtigste Teil der visuellen Welt in den Bereich des zentralen Sehens gerückt und mit höchster visueller Auflösung analysiert. Es ist deswegen nicht erstaunlich, daß die spezielle Topographie der Nervenzellen in der Netzhaut Auswirkungen auf die Organisation weiter zentral gelegener visueller Gebiete des Gehirns wie dem Corpus geniculatum laterale, dem Colliculus superior oder dem visuellen Cortex hat. Die Population der Photorezeptoren wird beim Menschen von den Stäbchen dominiert, die eine maximale Dichte von 170000/mm2 bei einer retinalen Exzentrizität von etwa 30° erreichen. Die visuellen Ereignisse in den zentralen 2° des visuellen Feldes, die auf die Fovea fallen, werden hier jedoch nicht von Stäbchen, sondern ausschließlich von Zapfen registriert. Die Dichte der Zapfen erreicht in der Fovea bis zu 300000/mm2. Das Auflösungsvermögen eines Auges (Sehschärfe) ist direkt korreliert mit der maximalen Rezeptordichte in der betreffenden Netzhaut. Die Verteilung der verschiedenen Typen von Ganglienzellen ähnelt der der Photorezeptoren. Im Bereich der Fovea liegen auch die Ganglienzellen, die deutlich größer sind als die Rezeptorzellen, viel dichter als in der Peripherie der Netzhaut. Mit der Abnahme ihrer Dichte nimmt die Spannweite der Ganglienzelldendriten jedoch zu. Dies geschieht in einer streng regulierten Weise, so daß sich an jedem Ort der Netzhaut eine konstante Anzahl von Ganglienzelldendriten jedes ihrer Subtypen überlappen. Ein von der retinalen Exzentrizität unabhängiger Überdeckungsfaktor wurde auch für Amakrinzellen, Horizontalzellen und ihre jeweiligen Subtypen beschrieben. Zur Ontogenese der Netzhaut siehe Zusatzinfo . Netzhautablösung.
R.B.I.

Netzhaut
Abb. 1: Der Augenhintergrund des Menschen, wie er mit Hilfe einer Funduskamera sichtbar wird. Nervenfasern und Blutgefäße treten am blinden Fleck (Papille) durch den Augenball hindurch. Die höchste Sehschäfe wird in der Fovea centralis durch die hohe Dichte von Photorezeptoren erreicht.
Netzhaut
Abb. 2: Ausschnitt aus der Netzhaut von Wirbeltieren: links Netzhaut eines Rhesusaffen, rechts schematische Darstellung
Abb. 4: Dichteverteilung von Stäbchen, Zapfen und retinalen Ganglienzellen durch die Netzhaut eines repräsentativen Primaten (Rhesusaffe). Exzentrizität bedeutet Abstand von der Fovea centralis auf der Retina. Beim Menschen entspricht der Abstand von einem Millimeter auf der Retina einem Sehwinkel von etwa 3°. Die besonders hohe Dichte von Zapfen und Ganglienzellen in der Fovea ist Grundlage für die hohe Sehschärfe im Zentrum des Gesichtsfelds. Die dämmerungsempfindlichen Stäbchen liegen besonders dicht nahe bei, aber nicht in, der Fovea.
Netzhaut
Ontogenese:
Die Netzhaut entwickelt sich aus der embryonalen Augenblase und ist folglich neuroektodermalen Ursprungs. In der frühen Retinogenese kommt es zu Wellen neuronaler Aktivität im Netzwerk retinaler Neurone noch bevor die Photorezeptoren gebildet werden. Diese frühe Aktivität im Netzwerk retinaler Neurone wird also nicht durch Lichtereignisse initiiert, sondern erfolgt spontan, und sie fließt nicht vorwiegend senkrecht zu den retinalen Schichten, wie dies in der reifen Retina der Fall ist, sondern horizontal zu ihnen. Die Wellen spontaner neuronaler Aktivität sorgen dafür, daß die Wahrscheinlichkeit einer zeitlich korrelierten Aktivität von zwei retinalen Ganglienzellen mit ihrer räumlichen Nähe zunimmt. Dieses Muster zeitlich korrelierter Aktivität in den Axonen und Synapsen der Ganglienzellen ist von entscheidender Bedeutung für die Ausbildung topographischer "Karten" nicht nur in den thalamischen und mesencephalen Zielgebieten des Opticus, sondern im ganzen visuellen System einschließlich des visuellen Cortex.


Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.