Lexikon der Neurowissenschaft: Neuropeptide
Neuropeptide, Gehirnpeptide, E neuropeptides, Sammelbezeichnung für eine große Zahl von Peptiden, die in verschiedenen, zum Teil nur sehr kleinen Arealen des Zentralnervensystems (ZNS) lokalisiert sind und über ihre Wirkung als Neurosekrete (Neurotransmitter, Neurohormone und Neuromodulatoren) das Verhalten sowie die Homöostase des Organismus in vielfältiger Weise beeinflussen ( siehe Abb. 1 ). Neuropeptide werden als Neurotransmitter depolarisationsinduziert in den synaptischen Spalt sezerniert und üben auf die postsynaptische Membran einen excitatorischen oder inhibitorischen Effekt aus. Als Modulator beeinflussen sie primär die Sensibilität von Nervenzellen gegenüber Transmittern. Als Neurohormon werden sie in das Blut oder die Cerebrospinalflüssigkeit abgegeben und gelangen so zu ihren Zielzellen. Durch Interaktion der Neuropeptide mit spezifischen Rezeptoren in der Zellmembran werden intrazelluläre Kaskaden aktiviert, die einen Anstieg der Konzentration an sekundären Boten und schließlich eine Änderung des Funktionszustands der Zielzelle bzw. ihrer Leistung bewirken. Die meisten Neuropeptide der Wirbeltiere sind ursprünglich nicht im ZNS, sondern in anderen Geweben, häufig im Gastrointestinaltrakt (gastrointestinale Hormone) und in der Adenohypophyse, oder als im Blut zirkulierende, hormonähnliche Substanzen nachgewiesen worden ( siehe Tab. ). So muß für jedes einzelne Neuropeptid geklärt werden, ob seine Synthese im ZNS selbst stattfindet, oder ob es von peripheren Organen synthetisiert und anschließend zu Gehirnbereichen, die über entsprechende Rezeptoren verfügen, transportiert wird. Durch die Verwendung spezifischer Antikörper für diese Peptide wurde es möglich, sie mit immuncytologischen Methoden in spezifischen Gehirnregionen nachzuweisen. – Bereits bei Prokaryoten und Einzellern kommen Peptide vor, die den Neuropeptiden sehr stark ähneln. Beispiele sind die Sequenzhomologie zwischen dem Alphafaktor (ein Pheromon) der Bäckerhefe Saccharomycescerevisiae mit Gonadoliberin oder ACTH-, β-Endorphin-, Vasotocin-, Somatostatin- und Relaxin-ähnliche Peptide im Ciliaten Tetrahymenapyriformis. Dies legt den Schluß nahe, daß – ähnlich wie bei den Hormonen – die spezifischen Funktionen der Neuropeptide vor allem über eine Evolution spezifischer Rezeptoren zu erklären ist. So wird auch verständlich, daß ähnliche Neuropeptide in verschiedenen Organismen unterschiedliche Funktionen haben, bzw., daß ein und dasselbe Neuropeptid auch in einem Organismus verschiedene Funktionen erfüllen kann. – Neuropeptide sind im allgemeinen Bestandteile langer Vorläufermoleküle (Präkursor), in denen der aktive Peptidanteil durch basische Aminosäuren flankiert wird. Aus diesen Vorläufermolekülen können sie durch spezifische Peptidasen herausgespalten und als aktive Peptide freigesetzt werden ( siehe Abb. 2 ); die auf ein Präkursormolekül zurückführbaren Neuropeptide bilden Peptidfamilien. So werden z.B. aus dem Proopiomelanocortin-Präkursormolekül (POMC) der Wirbeltiere durch tryptische Hydrolyse je nach Bedarf und Lokalisation des Präkursormoleküls (in ZNS, Gastrointestinaltrakt, Placenta, Lymphocyten, Lunge oder männlichen und weiblichen Geschlechtsorganen) 9 verschiedene aktive Neuropeptide freigesetzt (darunter Lipotropine, adrenocorticotropes Hormon [ACTH], β-Endorphin und Melanocortine). Die Präkursormoleküle selbst sind der Modifikation (Acetylierung des Aminoterminus, Phosphorylierung, Glykosylierung, Amidierung des Carboxylterminus und andere) zugänglich und können über derartige Substitutionen aktiviert oder inaktiviert werden. Die aktiven Neuropeptide entstehen also zum einen durch Expression der Präkursorgene, zum anderen durch anschließende gewebsspezifische Prozessierung der Genprodukte. Die Vielfalt der produzierten bioaktiven Peptide und ihre gewebsspezifische Expression ist also an eine entsprechende Expression von Prozessierungsenzymen sowie an die Gegenwart von Enzymmodulatoren geknüpft ( siehe Zusatzinfo ). – Es ist häufig schwierig, den Neuropeptiden eine klare und eindeutige Funktion zuzuordnen, da sie an verschiedenen Stellen des Organismus vorkommen, und häufig in einzelnen ZNS-Arealen (und sogar innerhalb einzelner Neurone) mehrere Neuropeptide nebeneinander lokalisiert sein können. Neuropeptide können sogar innerhalb eines Vesikels mit klassischen monoaminergen Transmittern colokalisiert sein (Colokalisation). Dennoch lassen sich im Rahmen der weniger komplexen Verhältnisse bei einigen niederen Tierspezies einzelne Gruppen von Neuropeptiden nach ihren Aufgaben zusammenfassen. So kennt man z.B. bei Krebstieren 5 Neuropeptide, die auf die Chromatophoren einwirken und den Farbwechsel kontrollieren (Pigment-Effektor-Hormone), sowie das hyperglykämische Hormon (Insektenhormone) und das Neurodepressing-Hormon (letzteres beeinflußt die lokomotorische Aktivität); alle diese Neuropeptide sind in der Sinusdrüse lokalisiert. Ferner kennt man 2 Peptide aus dem Perikardialorgan (wie die Sinusdrüse ein Neurohämalorgan), von denen eines große Ähnlichkeit mit dem die Muskelaktivität beeinflussenden Proctolin (ein Pentapeptid) der Insekten besitzt (Neuropeptide von Invertebraten siehe Zusatzinfo ). – Die überaus zahlreichen (wahrscheinlich mehr als 100 verschiedenen) Neuropeptide der Wirbeltiere beeinflussen praktisch sämtliche Funktionen des Nervensystems und darüber auch das Verhalten und die homöostatische Regulation des Organismus. So spielen sie etwa eine wichtige Rolle bei der Regulation höherer kognitiver und emotionaler Funktionen im Rahmen von Streß und Angst (z.B. Corticoliberin, ACTH, Vasopressin, Oxytocin, Cholecystokinin), bei der Regulation der Schmerzempfindung (z.B. Substanz P, endogene Opiate wie die Enkephaline, Endorphine und Dynorphine, Somatostatin, vasoaktives intestinales Peptid [VIP], Cholecystokinin, Angiotensin, Neurotensin, Bombesin), der Regulation reproduktiver und sozialer Verhaltensweisen (Oxytocin, Vasopressin, Gonadoliberin), der Regulation der Nahrungsaufnahme (Cholecystokinin, Melanocyten-stimulierendes Hormon, Insulin, Corticoliberin, Neuropeptid Y, Opiate), der Temperaturregulation (Thyreoliberin, endogene Opiate) sowie der Blutdruckregulation (Angiotensin, atriales natriuretisches Peptid, Vasopressin, VIP, Opiate). Darüber hinaus greifen sie auch in immunregulatorische Prozesse ein (Neuroimmunologie). Schließlich sind zahlreiche psychische Krankheiten (z.B. Schizophrenie) durch eine Veränderung der Konzentration von bestimmten Neuropeptiden gekennzeichnet.
K.G.C./J.B.
Lit:Hökfelt et al.: Peptidergic neurons, Nature 284, pp. 515-521, 1980.
Neuropeptide
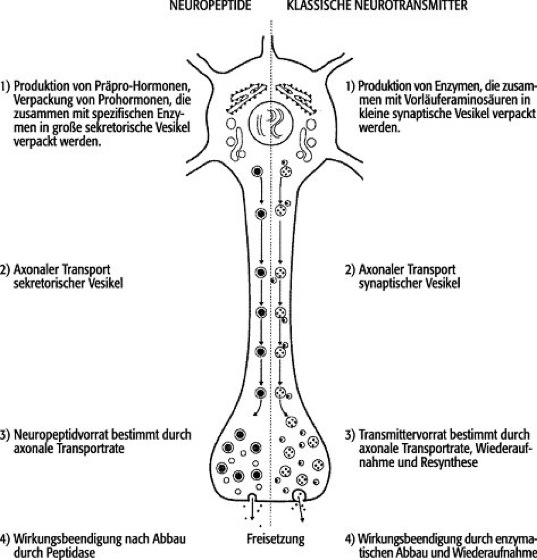
Abb.1: Vergleich der neuronalen Synthese, Speicherung und Freisetzung eines Neuropeptids (Cholecystokinin, links) und eines klassischen niedermolekularen Neurotransmitters (Dopamin, rechts).
Bei den klassischen Transmittern (rechte Seite) werden die Enzyme, die diese Substanzen aus entsprechenden Vorläufer-Aminosäuremolekülen synthetisieren, in den Ribosomen hergestellt. Sie werden dann zusammen mit den Transmittervorläufern in synaptische Vesikel verpackt (1) und per axonalem Transport zur synaptischen Endigung gebracht (2), wo die Transmittersynthese abgeschlossen und der Transmitter bei entsprechender Depolarisation der axonalen Endigung freigesetzt wird. Die Wirkung des Transmitters im synaptischen Spalt wird durch enzymatischen Abbau und Wiederaufnahme der Transmittermoleküle in die präsynaptische Endigung beendet (4). Der Vorrat des klassischen Transmitters in der axonalen Endigung bestimmt sich durch die mittels axonalem Transport bereitgestellte Transmittermenge und durch die Wiederaufnahme und Neusynthese von freigesetzter Transmittersubstanz in der präsynaptischen Endigung (3).
Bei der Synthese von Neuropeptiden (linke Seite) wird bei Stimulation der Nervenzelle über entsprechende Genaktivierung und Transkriptionsprozesse in den Ribosomen ein längeres Prä-Propeptid synthetisiert. In den Golgi-Apparaten werden aus diesem Vorläufer durch proteolytisch wirkende Enzyme peptiderge Prohormone "herausgeschnitten", die dann zusammen mit weiteren, spezifisch wirkenden Enzymen in sekretorische Vesikel verpackt (1) und zur axonalen Endigung transportiert werden (2), wobei die aktiven Neuropeptide hergestellt werden. Im Vergleich zu den nur klassische Transmitter transportierenden Vesikeln sind die Neuropeptide transportierenden Vesikel größer. Die Aktivierung der Neuropeptidfreisetzung ist träger als die der Freisetzung klassischer Transmitter (d.h., sie erfolgt in der Regel erst nach stärkerer Stimulation des Neurons). Nach Freisetzung des Neuropeptids erfolgt die Deaktivierung durch Peptidasen (4). Eine Wiederaufnahme wie bei den klassischen Transmittern besteht nicht. Im Gegensatz zu den klassischen Transmittern können Neuropeptide nicht in der axonalen Endigung resynthetisiert werden; ihre Synthese nimmt immer den längeren Weg über die Produktion von Prä-Propeptiden über den Zellkern. Der Neuropeptidvorrat im Synapsenendigungen wird also allein durch die axonale Transportrate bestimmt (3). Insofern stellt die Informationsübertragung mittels Neuropeptide im Vergleich zu der mittels klassischer, niedermolekularer Transmitter eine langsamere und phylogenetisch ältere Form der interneuronalen Kommunikation dar.
Neuropeptide
Auswahl einiger Neuropeptide von Wirbeltieren und Mensch:
| ||
| Neurohypophysen-Hormone | Vasopressin Oxytocin | |
| Adenohypophysen-Peptide | adrenocorticotropes Hormon (ACTH) β-Endorphin melanocytenstimulierendes Hormon (MSH) | |
| gastrointestinale Peptide | vasoaktives intestinales Polypeptid (VIP) Cholecystokinin (CCK) Gastrin Insulin Bombesin Sekretin Motilin | |
| ursprünglich in Nervengewebe beschriebene, aber auch im Gastrointestinaltrakt vorkommende Peptide | Substanz P Neurotensin Methionin-Enkephalin Leucin-Enkephalin Somatostatin | |
| andere | Angiotensin II atriales natriuretisches Peptid (ANP) Bradykinin delta-sleep inducing peptide (DSIP) Calcitonin calcitonin gene related peptide (CGRP) Neuropeptid Y |
Die Freisetzungshormone und Neurohypophysen-Hormone lassen sich in der Regel auch in Hirnregionen außerhalb des Hypothalamus nachweisen. Hinsichtlich der adenohypophysären Peptide ist nur für die genannten Abkömmlinge des Proopiomelanocortins die Synthese auch innerhalb des Zentralnervensystems gesichert. Für einige der genannten gastrointestinalen Peptide, wie z.B. Insulin, sind zwar ihr Vorkommen (und entsprechende Rezeptoren), nicht aber eine eigenständige Synthese im Gehirn nachgewiesen.
Neuropeptide
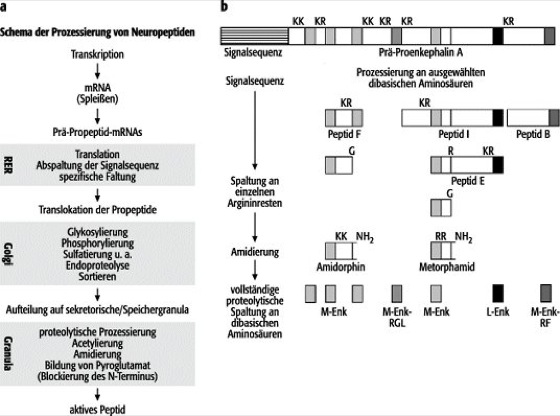
Abb.2:
a Schema der ProzessierungvonNeuropeptiden. Nach Genaktivierung und Transkription kann ein Teil der mRNA gespleißt (Spleißen) werden, was zu Sequenzen führt, die nicht direkt auf die Genstruktur zurückzuführen sind. Während der Translation wird das entstehende Präpolypeptid durch die Membran ins Innere des rauhen endoplasmatischen Reticulums (rER) transloziert, wobei N-terminale hydrophobe Signalsequenzen eine Rolle spielen. Anschließend kommt es zu spezifischen Faltungen der Polypeptidkette und Abspaltung der Signalsequenz. Die so gebildeten Propeptide werden in Golgi-Vesikeln eingeschlossen, wo sie weitere Veränderungen durch Glykosylierung, Phosphorylierung, Hydroxylierung, Sulfatierung und ähnliche Reaktionen erfahren. Ferner werden einzelne Propeptide auf spezifische sekretorische oder Speichergranula verteilt. Innerhalb der Granula kann die "Reifung" zu bioaktiven Peptiden weiter ablaufen; hier wirken insbesondere Endo- und Exopeptidasen sowie Reaktionen, die das N- oder C-terminale Ende der Peptide modifizieren.
bProzessierungvonPrä-Proenkephalin A (K = Lysin, R = Arginin, G = Glycin). Prä-Proenkephalin A enthält 4 Kopien von Met-Enkephalin (M-Enk), eine Kopie von Leu-Enkephalin (L-Enk), eine Kopie von Met-Enkephalin-Arg-Gly-Leu (M-Enk-RGL) und eine Kopie von Met-Enkephalin-Arg-Phe (M-Enk-RF), jeweils begrenzt durch eine dibasische Aminosäure (Arginin, Lysin). Durch proteolytische Prozessierung an spezifischen Orten mit dibasischen Aminosäuren entstehen die Peptide, die im Nebennierenmark gefunden werden (Peptid F, Peptid E, Peptid B und Peptid I). Eine Spaltung an einzelnen Argininresten und anschließende Amidierung führt zu Amidorphin oder Metorphamid. Die vollständige Spaltung an den dibasischen Aminosäuren setzt die Pentapeptid-Enkephaline sowie M-Enk-RGL und M-Enk-RF frei.
Neuropeptide
Bei der Prozessierung des Vorläufermoleküls müssen nicht alle durch die Struktur des Präkursormoleküls (insbesondere die Anordnung der basischen Aminosäuren) gegebenen Möglichkeiten zur Abspaltung von Peptiden auch wirklich genutzt werden. Die sequenzierte Struktur eines Präkursormoleküls erlaubt jedoch die Voraussage von möglichen Neuropeptiden, ohne daß deren physiologische Wirkung immer bekannt wäre. Für Cholecystokinin ist z.B. ein Präkursormolekül kloniert worden, welches die Sequenzen für die verschiedenen aktiven Formen des ursprünglich im Magen-Darm-Trakt gefundenen Neuropeptids (im Bereich von 4-58 Aminosäuren) enthält und gewebsspezifisch prozessiert wird. Das Carboxylende des Präprocholecystokinins besitzt Sequenzhomologien zum Gastrin. Viele der Enzyme, die für die Spaltung im Rahmen der Prozessierung zuständig sind, wurden bisher nur unzureichend charakterisiert, vor allem, was ihre Spezifität anbelangt (Wirkung an speziellen Propeptiden oder Peptidgruppen). Recht gut untersucht ist eines der Carboxypeptidase-B-ähnlichen Enzyme, die Enkephalin-Konvertase, welche eine wichtige Rolle für die Synthese verschiedener Neuropeptide spielt (Enkephaline). Die Enkephalin-Konvertase ist löslich und membrangebunden im Nebennierenmark und besonders in der Hypophyse lokalisierbar; sehr hohe Konzentrationen werden in der Eminentia mediana des Hypothalamus-Hypophysen-Systems gefunden.
Neuropeptide
Neuropeptide von Invertebraten:
Die überaus zahlreichen Neuropeptide der Invertebraten kontrollieren – wie bei den Wirbeltieren – die Aktivität endokriner Drüsen, beeinflussen aber stärker noch als die Neuropeptide der Wirbeltiere direkt physiologische Prozesse (Diapause, Reproduktion, Farbwechsel), rhythmische Prozesse (circadiane Aktivität, Flug, Schlüpfen), Arbeit der Visceralmuskeln, Osmoregulation, Stoffwechsel und Eiablageverhalten. Dies ergibt sich daraus, daß distinkte Hormondrüsen, die nicht-neuraler Herkunft sind, nach heutigem Kenntnisstand bei vielen Invertebraten noch nicht vorkommen. Erst bei höher entwickelten Gruppen finden sich derartige Drüsen, wie z.B. die Prothoraxdrüsen und die Corpora allata bei Insekten, sowie die Y-Organe, Mandibularorgane und das X-Organ-Sinusdrüsen-System bei Crustaceen. Bei Mollusken scheinen Drüsen dieser Art besonders selten zu sein. Zu nennen sind hier die optischen Drüsen von Octopus oder die Atrialdrüsen von Schnecken. Dennoch gibt es eine ausgeprägte formale Ähnlichkeit mit dem Hypothalamus-Hypophysensystem der Wirbeltiere beim Hormonsystem der Insektenentwicklung. Zu diesem gehören die am längsten bekannten Neuropeptide der Insekten, das prothorakotrope Hormon, das Pentapeptid Proctolin und das Dekapeptid AKH (adipokinetisches Hormon). Weitere Insektenneuropeptide sind die hypertrehalosämischenFaktoren, 2 Neuropeptide, die die Tönnchenbildung bei Dipteren kontrollieren, Herzschlag-aktivierende Faktoren (NeurohormonD, das große Ähnlichkeit mit dem adipokinetischen Hormon besitzt) und Peptide, die Pigmentwanderungen in den Chromatophoren regulieren ("Dunkelfaktor", "Hellfaktor"). Bei Mollusken sind 2 Neuropeptide beschrieben worden, die das Verhalten bei der Eiablage steuern (Eiablagehormon).
Inzwischen sind mehr als 50 Insekten-Neuropeptide beschrieben worden; ihre Zahl nimmt weiterhin rapide zu. Eine einheitliche Nomenklatur für diese Vielfalt ist zwar vorgeschlagen worden, hat sich aber bis jetzt noch nicht generell durchgesetzt. Ähnlich wie bei den Wirbeltieren können die Neuropeptide der Insekten in größere funktionelle Gruppen unterteilt werden: 1) Faktoren, die bei Entwicklungsprozessen eine Rolle spielen (prothorakotrope Hormone); 2) homöostatische Neuropeptide und solche, die das Verhalten beeinflussen: 2a) myotrope Peptide (cardioacceleratorische Neuropeptide, enddarmstimulierende Neuropeptide, Inhibitoren der Visceralmuskeln, Proctolin), 2b) metabolische Peptide (AKH/RPCH-Familie; adipokinetisches Hormon), 2c) diuretische Peptide, 2d) Eclosionshormon, 2e) Pheromon-Biosynthese aktivierende Peptide, 2f) pigmentdispergierende Peptide; 3) reproduktive Peptide (egg development neurosecretory hormone, oostatisches Hormon – trypsin modulating oostatic factor, Corpora allata stimulierende und inhibierende Faktoren, Allatostatine).
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.