Lexikon der Ernährung: Proteine
Proteine, Eiweiße, Eproteins, ausschließlich (einfache P.) oder überwiegend (komplexe P., Tab. 1) aus Aminosäuren aufgebaute Makromoleküle (Biopolymere, Mr > 10 kDa, vgl. Polypeptide), die ca. 50 % der Trockenmasse einer humanen Zelle ausmachen und deren Struktur und Funktion bestimmen als
Enzyme (Biokatalysatoren)Rezeptorproteine (z.B. LDL-Rezeptor)Immunglobuline (z.B. IgA, IgG)ZellerkennungsproteineStrukturproteine (z.B. Kollagen, Keratin)kontraktile Proteine (z. B. Actin, Myosin)Trägerproteine (z.B. Hämoglobin, Transferrin)P. bestehen wie Fette und Kohlenhydrate aus Kohlenstoff, Wasserstoff und Sauerstoff. Zusätzlich enthalten P. noch ca. 16 % Stickstoff sowie einige andere Minorelemente wie Schwefel und Selen. Unter Berücksichtigung von dreidimensionaler Struktur und Löslichkeit werden P. in globuläre (kugelförmig, wasserlöslich, = Sphäroproteine, hierzu gehören u. a. alle Enzyme) und fibrilläre P. (faserförmig, nicht wasserlöslich) eingeordnet. Am Aufbau der P. sind max. 20 proteinogene Aminosäuren beteiligt. Die Aminosäuren sind durch Peptidbindungen (Peptide) kovalent verknüpft, wobei die Reihenfolge (Sequenz) der Bausteine genetisch determiniert ist (Proteinbiosynthese).
Die chemische Struktur von P. wird durch folgende Parameter beschrieben:
Die Sekundär- und Tertiärstruktur werden zusammen als Konformation der P. bezeichnet.
Eine intakte Tertiärstruktur ist für die Funktion der P. Vorraussetzung, so wird die Aktivität von Enzymen und Transportproteinen u. a. durch Konformationsänderungen reguliert (Allosterie), geänderte Primär-/ Sekundär-/Tertiärstrukturen von Enzymproteinen können Ursache von Enzymopathien sein, die Infektiösität von Prionen beruht auf einer unphysiologischen Tertiärstruktur. P. besitzen analog den Aminosäuren einen isoelektrischen Punkt, bei starken Abweichungen von diesem pH-Wert oder bei Temperaturen oberhalb 40 °C denaturieren sie (Zerstörung der Tertiär- und ggf. Quartärstruktur). Dies kann bei der Nahrungszubereitung erwünscht sein – so wird die Verdaulichkeit durch Denaturierung teilweise erhöht, während die schädliche Wirkung z. B. von Protease-Inhibitoren aufgehoben wird. Nicht alle P. enthalten alle 20 proteinogenen Aminosäuren; Fehlen einer oder mehrerer Aminosäuren beeinflusst die Proteinqualität.
Verdauung und Stoffwechsel: P. kommen in pflanzlichen und tierischen Lebensmitteln vor. Bisher ist die Struktur von ca. 1000 P. aufgeklärt. Mit der Nahrung zugeführte Proteine unterliegen einer effizienten Verdauung im Magen und im Darm, katalysiert durch eine Reihe von Enzymen (Tab. 2). Die Salzsäure im Magen denaturiert die P. und aktiviert gleichzeitig Pepsin. Letztendlich entstehen kleine Peptide (Di- und Tripeptide) sowie freie Aminosäuren. Für diese Substrate existieren spezifische, aktive Transportsysteme (Aminosäuren- bzw. Peptidtransporter), die größtenteils unabhängig arbeiten. Peptide werden in der Regel schneller aufgenommen; der Transport scheint direkt mit der Hydrolyse in die freien Aminosäuren verbunden zu sein. Im Cytosol der Mucosazelle und im Blut sind nur noch Aminosäuren nachweisbar (Ausnahme: hydrolyseresistente Dipeptide wie Glycyl-Prolin).
Ernährungsphysiologische Bedeutung: P. liefern Stickstoff sowie unentbehrliche (essenzielle) Aminosäuren. Im Vergleich zu Fetten und Kohlenhydraten sind P. keine dominierende Energiequelle, auch wenn der physiologische Brennwert mit 4,1 kcal / g bzw, 17,2 kJ / g dem der Kohlenhydrate entspricht. (Der physikalische Brennwert von P. ist mit 5,4 kcal / g bzw. 22,6 kJ / g höher, jedoch benötigt der Organismus einen Teil der Energie zur Synthese des Stickstoff-Ausscheidungsproduktes Harnstoff und verliert Energie über ausgeschiedene Aminosäuren.) Unter normalen Umständen decken Nahrungsproteine ca. 15–20 % des täglichen Energieumsatzes (erhöhter Proteinabbau bei Postaggressions-Syndrom).
Proteine als Nahrungsbestandteile können auch unerwünschte Wirkungen als Allergene, Auslöser von Unverträglichkeitsreaktionen (Gluten) oder in Form der Protease-Inhibitoren haben.
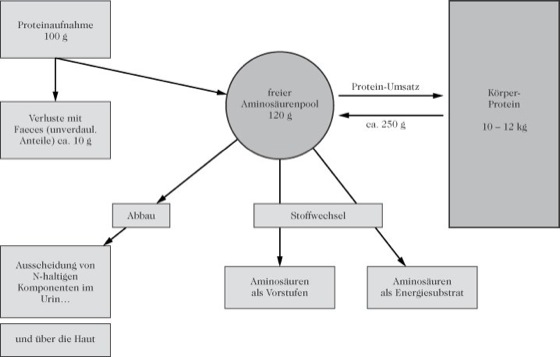
Der Proteinstoffwechsel ist durch ein dynamisches Gleichgewicht zwischen Aufbau (Anabolismus) und Abbau (Katabolismus) charakterisiert (Protein-Umsatz, Abb.). Ein gesunder Erwachsener weist ca. 10–12 kg Körperprotein auf. Von dieser Menge werden pro Tag ca. 300 g (bei Heranwachsenden ca. 500–600 g) auf- und wieder abgebaut. Die Aminosäuren für den Aufbau entstammen dem freien Aminosäurenpool (Aminosäuren). Die Halbwertszeit der Körperproteine ist sehr unterschiedlich und wird vor allem durch die physiologische Funktion bestimmt (Tab. 3). Der Organimsus verliert täglich obligat eine bestimmte Menge an Stickstoff (Ausscheidung vorwiegend als Harnstoff) als Ergebnis des Proteinkatabolismus. Die Zufuhr an Nahrungsprotein muss diese Verluste in jedem Fall ausgleichen (Stickstoffbilanz; Proteinqualität). Die Zufuhrempfehlungen werden für Protein formuliert, auch wenn der physiologische Bedarf die Aminosäuren betrifft (Tab.). Hauptorgane des Proteinstoffwechsels sind die Leber und die Nieren (Weitere Abbau- und Umbauvorgänge sind bei den einzelnen Aminosäuren beschrieben).
Proteine: Tab. 1. Allgemeine Einteiung der Proteine.
| ||
| Albumine | Lactalbumin der Milch, Serumalbumin | |
| Globuline | Ovoglobulin im Hühnerei, Globuline des Blutes | |
| Gluteline | Getreidegluteline | |
| Prolamine | Gliadin in Weizen, Zein in Mais | |
| Albuminoide | Kollagen in Bindegewebe, Kreatin der Haare | |
| komplexe (konjugierte) Proteine (früher als Proteide bezeichnet) | ||
| Glycoproteine / Mucoproteine | Komplexe aus Kohlenhydraten und Protein, z. B. Mucin | |
| Phosphoproteine | Proteine mit phosphorhaltigen Aminosäuren, z. B. Caseine der Milch | |
| Chromoproteine | Komplexe aus Proteinen und chromophoren Gruppen, z. B. Hämoglobin | |
| Lipoproteine | Komplexe aus Proteinen und Lipiden, z. B. HDL, LDL | |
| Metalloproteine | Komplexe aus Proteinen und Metall-Ionen, z. B. Ferritin | |
Proteine: Tab. 2. Verdauung von Proteinen im Gastrointestinaltrakt.
| ||||
| gastrale Proteasen | ||||
| Gastricin | Proteine | hohe Spezifität für lösliches Casein | ||
| Pepsine | Pepsinogen | Proteine | Hydrolyse an N-ständigen aromatischen Aminosäuren | |
| pankreatische Proteasen | ||||
| Trypsin | Trypsinogen | Poly-/ Oligopeptide | Hydrolyse C-ständig von Lysin oder Arginin | |
| Chymotrypsin | Chymotrypsinogen | Poly-/ Oligopetide | Hydrolyse C-ständig von Tyrosin oder Phenylalanin | |
| Elastase | Proelastase | Oligopetide | Hydrolyse an aliphatischen Aminosäureresten, z. B. Alanin, Glycin, Serin | |
| Carboxypeptidase A | Procarboxypeptidase A | Polypetide | Abspaltung von Arginin oder Lysin am freien C-Terminus | |
| Carboxypeptidase B | Procarboxypeptidase B | Polypeptide | Abspaltung von Arginin oder Lysin am freien C-Terminus | |
| Peptidasen der Bürstensaummembran | ||||
| Dipeptidasen | – | Di- und Tripeptide | unspezifisch (Ausnahme: Xaa-Pro werden nicht gespalten; spezielle Prolidase) | |
Proteine: Tab. 3. Physiologische Halbwertszeit (HWZ) einiger Proteine.
| ||
| Kollagen | mehrere Jahre | |
| Myosin (Skelettmuskel) | 50–60 Tage | |
| Herzmuskelprotein | 11 Tage | |
| Transferrin | 8,5 Tage | |
| IgM | 5 Tage | |
| IgE | 2,5 Tage | |
| Präalbumin | 1,9 Tage | |
| Glucokinase (Leber) | 12 Stunden | |
| Phosphoenolpyruvat-Kinase (Leber) | 5 Stunden | |
| Ornithin-Decarboxylase (Leber) | 12 Minuten |
Proteine: Tab. Empfohlene Zufuhr [Quelle: DACH, Referenzwerte für die Nährstoffzufuhr, Umschau-Braus Verlag, Frankfurt, 2000]
| |||
| Männer | Frauen | ||
| bis 1 Monat | 12 | ||
| 1–12 Monate | 10 | ||
| 1–4 Jahre | 14 | 13 | |
| 4–7 Jahre | 18 | 17 | |
| 7–10 Jahre | 24 | 24 | |
| 10–13 Jahre | 34 | 35 | |
| 13–15 Jahre | 46 | 45 | |
| 15–19 Jahre | 60 | 46 | |
| 19–25 Jahre | 59 | 48 | |
| 25–51 Jahre | 59 | 47 | |
| 51–65 Jahre | 58 | 46 | |
| 65 Jahre und älter | 54 | 44 | |
| Schwangere ab 4. Monat | 58 | ||
| Stillende1 | 63 | ||
1 = Ca. 2 g / 100 g sezernierte Milch
Proteine: Protein-Umsatz im Körper. Proteine
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.