Lexikon der Neurowissenschaft: Telencephalon
Telencephalons [von griech. telos = Ende, Ziel, egkephalos = Gehirn], Endhirn, Etelencephalon, endbrain, der vorderste Abschnitt des Gehirns der Wirbeltiere (Chordaten-Nervensystem, Tab.). Es entsteht ontogenetisch aus dem vorderen Abschnitt des blasenförmigen Prosencephalons (dessen hinterer Abschnitt differenziert sich zum Diencephalon). Der telencephale Teil des Prosencephalons unterliegt im Laufe der Ontogenese drastischen Form- und Größenveränderungen, die bei verschiedenen Tiergruppen sehr verschieden ablaufen und deshalb auch zu sehr verschiedenen adulten Ergebnissen führen. Bei allen Wirbeltieren dehnt sich der telencephale Teil des Prosencephalons schon früh in der Ontogenese rasch aus, die Größenzunahme resultiert in Evaginationen (Ausstülpungen), die nach rostral, lateral und caudal gerichtet sein können ( siehe Abb. 1 , rechter Teil). Diese paarig ausgestülpten Teile des Telencephalons bilden die Hemisphären, die in ihrem Innern die Seitenventrikel enthalten. Von jeder Hemisphäre wiederum wächst der Bulbus olfactorius nach rostral aus; je nachdem, wie weit sein Wachstum geht, entsteht ein sessiler (z.B. Nagetiere) oder ein pedunculierter (z.B. Mensch) Bulbus olfactorius, der über einen mehr oder weniger langen olfaktorischen Trakt mit der Hemisphäre verbunden ist. Diejenigen Teile des Telencephalons, die an diesen Evaginationen nicht teilnehmen und die daher in der Umgebung des Foramen Monroi liegen, werden im Gegensatz zu den Hemisphären als Telencephalon impar bezeichnet. Parallel zu den Evaginationen kommt es meist zu einer "Einrollung" (Inversion) der dorsalen Abschnitte (des späteren Palliums) der Wände des Prosencephalons. Die ehemalige Dachplatte des Neuralrohrs wächst dabei stark in die Länge, wird vaskularisiert und als Adergeflecht in das Innere der Seitenventrikel und des dritten Ventrikels verlagert. Dieser Typus des Telencephalons, wie er für fast alle Wirbeltiere mit Ausnahme der Knochenfische (s.u.) typisch ist, wird als Inversionstelencephalon bezeichnet. Bei Knochenfischen ( siehe Abb. 1 , linker Teil) ist die Evagination des Prosencephalonbläschens überwiegend nach rostral gerichtet; am Vorderende des sich ausdehnenden Prosencephalons entstehen durch weitere paarige, symmetrische Evaginationen die Bulbi olfactorii. Sie behalten die ursprünglich rohr- oder blasenförmige Gestalt des Prosencephalons bei, während die weiter caudal gelegenen Abschnitte eine Eversion erfahren (man spricht daher bei Knochenfischen auch von einem Eversionstelencephalon). Im Zuge dieser Eversion werden die dorsalen Abschnitte (das spätere Pallium) des Prosencephalons nach außen geklappt. Die Dachplatte wird dabei zu einer dünnen, gefäßführenden Haut ausgezogen (der Tela choroidea), die den Ventrikelraum, der nun an der Außenfläche des Vorderhirns liegt, bedeckt.
Trotz der unterschiedlichen Ontogenesen besteht das Telencephalon der Wirbeltiere aus einer Reihe von stets wiederkehrenden Bauelementen ( siehe Abb. 1 ; Chordaten-Nervensystem, Abb. 5). Stets tritt der paarige Olfactorius in die paarigen Bulbi olfactorii ein, deren Axone wiederum (die sekundärolfaktorischen Bahnen) sich zum Tractus olfactorius vereinigen und die zu verschiedenen Zielen (s.u.) in den Hemisphären und im Diencephalon ziehen. Bei Landwirbeltieren kann ein zweiter paariger akzessorischer Bulbus olfactorius vorhanden sein. Er nimmt die Axone aus dem vomeronasalen Organ auf, seine Efferenzen sind zu einem Teil der Amygdala gerichtet. Parallel zum Olfactorius verläuft bei den meisten Wirbeltieren (mit Ausnahme der Neunaugen und Schleimaale) der Nervus terminalis, dessen Zielgebiete überwiegend im Septum und im Hypothalamus liegen. Die Hemisphären bestehen stets aus einem dorsalen Teil, dem Pallium (Mantel) und einem ventralen Teil, dem Subpallium. Die pallio-subpalliale Grenze ist chemoarchitektonisch meist gut definiert: das Subpallium enthält zahlreiche peptiderge und cholinerge Neuronenpopulationen, während die Masse der Neurone im Pallium glutamaterg ist. Das Pallium vieler Wirbeltiere läßt sich in drei Abschnitte gliedern: ein laterales Pallium (Palaeopallium), ein dorsales Pallium (Neopallium) und ein mediales Pallium (Archipallium). Das laterale und (bei Anamnioten) mediale Pallium sind Zielorte der sekundärolfaktorischen Projektionen, das dorsale und mediale Pallium werden von aufsteigenden Verbindungen aus dem dorsalen Thalamus (Diencephalon) erreicht. Während die Efferenzen des lateralen Palliums meist auf das Pallium der Hemisphären beschränkt sind, erreichen die Efferenzen des dorsalen und des medialen Palliums stets das Subpallium und den Hypothalamus (Fornix). Das Vorkommen langer, bis in Hirnstamm und Rückenmark absteigender Efferenzen des (dorsalen) Palliums (Tractus corticonuclearis, Tractus corticospinalis: Pyramidenbahn) ist eine Besonderheit der Säugetiere. In allen diesen Pallien können sich (gleichnamige) Cortices entwickeln, d.h. Schichten von Neuronen, die von ihrer ontogenetisch ursprünglichen Lage in der Nähe des Ventrikels zur Hirnoberfläche hin gewandert sind. Notabene ist das Vorkommen solcher Cortices weder auf den Menschen oder die Säugetiere, noch auf das Pallium begrenzt, auch im Subpallium können cortexartige Zellschichten vorkommen (s.u.). Das Subpallium gliedert sich in einen medialen Teil, das Septum, und in einen lateralen Teil, das Striatum. Das Septum ist (bei vielen Wirbeltieren) ebenfalls ein Zielort der sekundärolfaktorischen Bahnen (und des Nervus terminalis), es projiziert seinerseits (cholinerg) in fast alle Gebiete des Telencephalons, besonders aber in das darüberliegende mediale Pallium. Das Striatum empfängt aufsteigende Projektionen aus dem dorsalen Thalamus und aus (dopaminergen) Zellgruppen des vorderen Tegmentums (Substantia nigra, Mesencephalon). Seine efferenten Projektionen richten sich auf viele Ziele im Di- und Mesencephalon (darunter eine rückläufige Projektion zur Substantia nigra), besonders aber auf Zellgruppen an der Grenze von Di- und Telencephalon, die bei Säugern als Pallidum, bei Anamnioten als Nucleus entopeduncularis anterior bezeichnet werden. Die Amygdala (der Mandelkern) ist ein Kerngebiet des caudalen Telencephalons, an der Grenze des lateralen Palliums zum Subpallium gelegen. Sie ist bei aquatischen Wirbeltieren nicht sehr ausgeprägt, erreicht aber bei Reptilien und vor allem bei Säugetieren (s.u.) eine beträchtliche Größe. – Stets sind die paarigen, hemisphärischen Anteile des Telencephalons durch wohlentwickelte Kommissuren miteinander verbunden. Diese Kommissuren, d.h. die Commissura anterior, die Commissura pallii, bei Säugern das Corpus callosum (Balken) und der Fornix liegen in der Lamina terminalis (Chordaten-Nervensystem, Abb. 5), auch die (diencephale) Commissura habenularum dient telencephalen Axonen zur Kreuzung auf die Gegenseite.
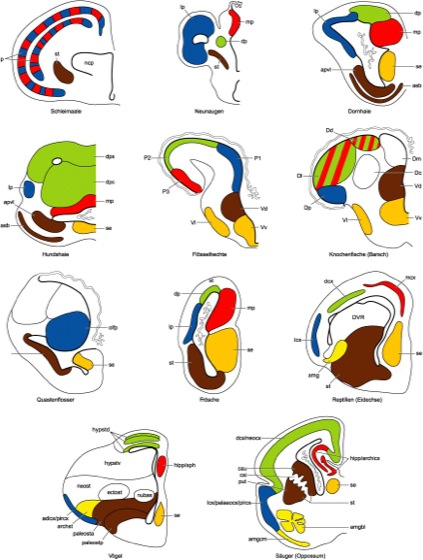
Vergleichende Anatomie ( siehe Abb. 2 ): Anhand einer Reihe von stark schematisierten Schnitten durch den mittleren Teil des Telencephalons verschiedener Wirbeltiere sollen im folgenden deren typische Merkmale und Unterschiede dargestellt werden. – Das Telencephalon der Schleimaale(Myxinoidea) ist einzigartig, indem es, anders als das aller anderen Wirbeltiere, keine Seitenventrikel besitzt. Sie werden zwar angelegt, ihr Lumen geht jedoch im Laufe der Ontogenese wieder verloren. Schleimaale besitzen ein mächtiges Pallium und ein vergleichsweise schmächtiges und wenig differenziertes Subpallium. Ihr Pallium weist einen Cortex auf, in dem 5 Schichten grauer und weißer Substanz alternieren. Dieser Cortex wird von sekundärolfaktorischen Projektionen aus dem Bulbus olfactorius, aber auch von aufsteigenden Projektionen aus dem Diencephalon erreicht. Die typische Dreiteilung des Palliums in einen dorsalen, medialen und lateralen Abschnitt ist nicht erkennbar, vielleicht entspricht ihr Cortex/Pallium insgesamt den lateralen und medialen Pallien anderer Schädeltiere. Im Zentrum des Telencephalons liegt ein Kerngebiet, dessen Homologie unklar ist. – Das Telencephalon der Neunaugen(Petromyzonta) besitzt recht kleine Hemisphären, die zur Gänze vom lateralen Pallium gebildet werden. Das mediale und das dorsale Pallium nehmen an der Bildung der Hemisphären nicht teil, sie liegen im Telencephalon impar. Das laterale und das mediale Pallium empfangen die Hauptmasse der sekundärolfaktorischen Projektionen. Das Subpallium enthält ein (unauffälliges) Septum und Striatum. – Bei manchen Knorpelfischen (z.B. Squalus, Dornhai) sind die Wände der Hemisphären relativ dünn, bei anderen (z.B. Mustelus, Hundshai, aber auch bei Rochen) sind sie gewaltig verdickt. Stets lassen sich die drei pallialen Felder unterscheiden, stets sind die sekundärolfaktorischen Projektionen auf das (oft recht kleine) laterale Pallium begrenzt. Das Subpallium der Knorpelfische weist in seinem lateralen Quadranten (also im Bezirk des Striatums) eine auffällige corticale Zellformation auf, die als Area superficialis basalis bezeichnet wird. Sie ist möglicherweise das Homologon des Pallidums der Säugetiere. Der Nervus terminalis ist bei den Knorpelfischen stets wohlentwickelt. – Die Flösselhechte (Polypterus) tragen ein typisch evertiertes (s.o.) Telencephalon. Durch die Eversion werden die Lagebeziehungen im Pallium derart verändert, daß es wenig Sinn macht, von medialem, lateralem und dorsalem Pallium zu reden. Es hat sich daher eingebürgert, ihre pallialen Areale mit "P 1-3" zu bezeichnen, ihre subpallialen (ventralen) Telencephalonabschnitte hingegen mit "V". Trotz der Änderungen der Lagebeziehungen durch die Eversion lassen sich auch bei ihnen die Homologa der typischen telencephalen Bausteine der Wirbeltiere erkennen, so entspricht z.B. ihr mediales palliales Gebiet (P 1) dem lateralen Pallium anderer Wirbeltiere, da es die Masse der sekundärolfaktorischen Projektionen aufnimmt. – Sehr viel schwieriger ist die Identifikation einzelner Areale bei den meisten anderen Knochenfischen (Teleostei), bei denen zur Eversion noch eine starke Verdickung der Wände des Telencephalons hinzutritt. Ihre pallialen Abschnitte werden mit "D" (für dorsal) bezeichnet, und nur einige von ihnen (so etwa Dp, das dem olfaktorischen lateralen Pallium entspricht) sind mit denen anderer Wirbeltiere direkt vergleichbar. – Auch der Quastenflosser (Latimeria) besitzt ein massiv verdicktes Pallium, in dem nur das olfaktorische Pallium mit einiger Sicherheit identifizierbar ist. Seine Hemisphären sind zum Teil evertiert (im Pallium, so daß das olfaktorische Pallium medial liegt, wie bei den Flösselhechten) und zum Teil evaginiert (im Subpallium). – Das Telencephalon der Amphibien ist wie das aller Landwirbeltiere evaginiert und invertiert. Es ähnelt in seinem einfachen Aufbau dem mancher Haie (s.o.), corticale Felder fehlen jedoch sowohl im Pallium als auch im Subpallium. – Reptilien besitzen Cortices im medialen, lateralen und dorsalen Pallium. Aus der ventrolateralen Hemisphärenwand wölbt sich ein mächtiger Wulst gegen den Ventrikel vor, der das Lumen des Ventrikels bei einigen Arten fast verschwinden läßt. Er wird als "DVR" (von E dorsal ventricular ridge;dorsaler ventrikulärer Kamm) bezeichnet. Die Basis des DVR wird vom Striatum gebildet, der eigentliche DVR jedoch, welcher der Zielort aufsteigender thalamischer Projektionen ist, besteht aus Zellgruppen, deren Homologie unklar ist. Bei Reptilien tritt außerdem eine wohldifferenzierte Amygdala auf, ein Kerngebiet an der Grenze von lateralem Cortex und Striatum. Bei Arten mit gut entwickeltem vomeronasalem Organ (z.B. Schlangen) ist sie zum mächtigen Nucleus sphaericus entwickelt. – Im Telencephalon der Vögel(Aves) sind die Cortices nur schwach entwickelt, lediglich in der Nähe des Tractus olfactorius findet sich ein unauffälliger "anterodorsaler lateraler Cortex" und ein "piriformer Cortex", die dem lateralen Pallium entsprechen. Die Seitenwände des Telencephalons sind massiv verdickt; ähnlich dem DVR der Reptilien verdrängen sie das Lumen der Seitenventrikel bis auf einen engen Schlitz. Diese Wände bestehen aus dichtgepackten Neuronenmassen, die nur durch dünne Lagen weißer Substanz (Laminae medullares) voneinander abgegrenzt sind. Historischerweise werden sie alle mit dem Suffix "-striatum" bezeichnet, obwohl tatsächlich nur das Palaeostriatum primitivum und das Palaeostriatum augmentatum dem Striatum anderer Wirbeltiere entsprechen. Das Hyperstriatum dorsale der Vögel (auch als "Wulst" bezeichnet; Hyperstriatum) ist wohl das Homologon des dorsalen Palliums (und damit des Neocortex), die Homologien von Ectostriatum, Neostriatum und Hyperstriatum ventrale sind umstritten. Ähnlich wie die DVR der Reptilien erhalten diese Gebiete spezifische sensorische Eingänge aus dem Thalamus. Auch Vögel besitzen eine Amygdala, sie wird als Archistriatum bezeichnet. Recht weit rostral im Telencephalon, eingebettet in das Neostriatum, liegt der Nucleus basalis. Er erhält eine direkte (also nicht im Thalamus verschaltete) sensorische Projektion aus dem somatosensiblen Kern des Trigeminus, über die ihm taktile Informationen aus der Schnabelgegend zufließen. Dieser telencephale Kern kommt nur bei Vögeln vor. – Die Gestalt des Telencephalons der Säugetiere(Mammalia) hängt stark vom Entwicklungsgrad und der Ausdehnung des dorsalen (Neo-)Cortex ab. Selbst bei Säugern, deren Neocortex nicht allzu mächtig ist (z.B. Oppossum, siehe Abb. 2 ) überwachsen die lateralen Teile des dorsalen Cortex und der laterale Cortex die ventrolaterale Hemisphärenwand und drängen das Striatum in die Tiefe. Das Striatum selbst wird durch die Capsula interna (afferente und efferente Faserbahnen des Neocortex) in einen ventrikelnahen (Caudatum) und einen ventrikelfernen (Putamen) Abschnitt unterteilt. Diese im Inneren des Telencephalons gelegenen Kerngebiete, zusammen mit dem basilateralen Teil der Amygdala und dem (diencephalen) Pallidum werden zusammenfassend als Basalganglien den corticalen Formationen des Telencephalons gegenübergestellt. – Bei manchen Säugetieren (inbesondere beim Menschen und bei Walen) erreicht der dorsale (Neo-)Cortex eine geradezu groteske Ausdehnung. Diese Größenzunahme wirkt sich drastisch auf die Gestalt und die Lagebeziehungen des Telencephalons aus. ( siehe Abb. 3 , siehe Abb. 4 ) Es kommt zu einer Auffaltung des Neocortex, die sich in Windungen (Gyri) und Furchungen (Sulcus) der Oberfläche des Telencephalons äußert. Telencephala, die solche Windungen aufweisen (viele Primaten, Wale, Huftiere, Carnivoren, aber auch Schnabeligel) werden als "gyrencephale" Telencephala bezeichnet, dort, wo Windungen und Furchen fehlen (z.B. Nagetiere) redet man von "lissencephalen" Telencephala. Dramatischer noch sind die Änderungen der Lagebeziehungen innerhalb der Hemisphären, die durch die Größenzunahme des Neocortex provoziert werden. Diese Verschiebungen werden als Hemisphärenrotation bezeichnet. Das starke ontogenetische Wachstum des dorsalen (Neo-)Cortex zwingt die Hemisphären in der beengten Schädelkapsel zu einer Wachstumsbewegung, die die hinteren Pole der Hemisphären beiderseits seitlich abwärts und dann wieder vorwärts am Hirnstamm vorbeidrängt ( siehe Abb. 3 , oben). So entstehen der Schläfenlappen und die Sylvius-Furche, die allen Nicht-Säugern fehlen. Viele oberflächliche und tiefe Strukturen im Telencephalon werden bei dieser Drehbewegung mitgenommen, teilweise oder ganz in den Schläfenlappen verlagert und typisch bogenförmig umgestaltet (so z.B. der Fornix oder die Commissura palli, die zum Balken umgestaltet wird). Strukturen, die anfänglich nicht benachbart waren (z.B. der laterale und der mediale Cortex), kommen dicht nebeneinander zu liegen. Das menschliche Telencephalon ( siehe Abb. 4 ) weist daher ein Querschnittbild auf, das stark von dem anderer Wirbeltiere abweicht; der laterale (Palaeo-)Cortex, der mediale (Archi-)Cortex (oder Hippocampusformation), der corticomediale Teil der Amygdala und der (namensgebende) Schweif des Schweifkerns (Cauda nuclei caudati) sind zur Gänze in den Schläfenlappen verlagert. An die ehemalige Lage des Hippocampus an der dorsomedialen Innenfläche der Hemisphären erinnert noch eine dünne Schicht grauer Substanz (das Indusium griseum), die dem Balken aufliegt und mit dem eigentlichen Hippocampus in Verbindung steht. Chordaten-Nervensystem, Gehirn, Großhirn, Großhirnlappen, Großhirnrinde, Neocortex, Nervensystem.
H.W.

Telencephalon
Abb. 1: Stark schematisierte Darstellung der unterschiedlichen Morphogenesen der Wirbeltiergehirne. Die Konturen des Ventrikels in den schematischen Schnitten sind durch dickere Linien hervorgehoben. Die gepunktete Linie markiert die pallio-subpalliale Grenze.
Mitte (Gehirnanlage): Unten ist eine Dorsalansicht der Gehirnanlage dargestellt, die unterbrochenen Linien stellen die Umrisse des (von außen nicht sichtbaren) Ventrikelsystems dar. Die Augenanlagen haben sich an der Ventralseite bereits aus dem hinteren (diencephalen) Teil des Prosencephalons ausgestülpt. Darüber ist ein Querschnitt durch den zu diesem Zeitpunkt noch nicht evaginierten vorderen Teil des Prosencephalons (also durch das spätere Telencephalon) abgebildet. Das Dach des Neuralrohrs wird durch die nicht-neuronale Dachplatte gebildet, die Bodenplatte setzt sich nicht bis in das spätere Telencephalon fort. Die Wände des Neuralrohrs bestehen aus einem dorsalen (pallialen) und einem ventralen (subpallialen) Abschnitt. Es ist noch nicht eindeutig geklärt, ob diese Abschnitte der Grundplatte bzw. Flügelplatte der caudaleren Hirnregionen entsprechen.
Rechts: Entwicklungsgang eines Inversionstelencephalons (Wirbeltiere außer Knochenfische). Die Augenanlagen sind bis auf den Opticus weggelassen. In der Dorsalansicht ist an der rechten Hemisphäre ein sessiler Bulbus olfactorius mit kurzem Tractus olfactorius dargestellt, links ein pedunculierter Bulbus mit langem Trakt. Die ursprünglich in den Bulbi und Tractus vorhandenen Ventrikelräume schwinden bei vielen Wirbeltieren im weiteren Lauf der Ontogenese. Rechts daneben sind zwei Querschnitte auf verschiedenen Höhen der Hemisphären dargestellt, der untere, caudalere Querschnitt zeigt die typische Inversion (Einwärtsrollung) der Seitenwände des Telencephalons. Der Farbcode verdeutlicht die evaginations-/inversionsbedingten Lageveränderungen der Strukturen in den telencephalen Wänden im Vergleich zu denen des ursprünglichen Neuralrohrs (Mitte oben).
Links: Entwicklungsgang eines Eversionstelencephalons (Knochenfische). Die Wände des Neuralrohrs klappen über große Bereiche des Telencephalons (nicht aber in den Bulbi olfactorii, links oben) nach außen (Eversion, Auswärtsrollung). In der Folge kommt der Ventrikel an der Oberfläche des Gehirns zu liegen, die Dachplatte wird zu einer dünnen Tela choroidea ausgezogen. Durch die Eversion ändern sich die Lagebeziehungen im Vergleich zu den invertierten Telencephala (siehe Farbcode) derart, daß deren (lagebezogene) Terminologie (mediales, laterales, dorsales Pallium) nicht auf die evertierten Pallien übertragen werden kann. Es gibt daher eine eigene Terminologie zur Beschreibung der evertierten Telencephala ( siehe Abb. 2 ).
Farbcode: grün: Homologa des dorsalen Palliums; blau: Homologa des lateralen Palliums; rot: Homologa des medialen Palliums; orange: Homologa des Septums; braun: Homologa des Striatums; gelb: Homologa der Amygdala; violett: Dachplatte und sich daraus entwickelnde Strukturen; farblos: Strukturen; deren Homologie unklar/umstritten ist.
Abk.: adlcx/pircx anterodorsolateraler und piriformer Cortex; amg Amygdala; amgcm corticomediale Amygdala; amgbl basilaterale Amygdala; apvl Area periventricularis ventrolateralis; archicx Archicortex; archst Archistriatum; asb Area superficialis basalis; bolf Bulbus olfactorius; cai Capsula interna; capcau Caput nuclei caudati; cau Nucleus caudatus; caucau Cauda nuclei caudati; cb Cerebellum; coa Commissura anterior; cocal Corpus callosum; copal Commissura pallii; Dc Pars centralis areae dorsalis; dcx dorsaler Cortex; Dd Pars dorsalis areae dorsalis; di Diencephalon; Dl Pars lateralis areae dorsalis; Dm Pars medialis areae dorsalis; dp dorsales Pallium; Dp Pars posterior area dorsalis; dpc dorsales Pallium, Pars centralis; dps dorsales Pallium, Pars superficialis; DVR dorsal ventricular ridge (dorsaler ventrikulärer Kamm); ectost Ectostriatum; fisslat Fissura lateralis (Sylvius-Furche); fo Fornix; forint Foramen interventriculare (Foramen Monroi); hipp Hippocampusformation; hipp/aph Hippocampusformation/Area parahippocampalis; hypstd Hyperstriatum, Pars dorsalis; hypstv Hyperstriatum, Pars ventralis; in insula; lamterm Lamina terminalis; lcx lateraler Cortex; lotemp Lobus temporalis; lp laterales Pallium; mch Membrana choroidea (Tela choroidea); mcx medialer Cortex; mes Mesencephalon; mp mediales Pallium; ncp Nucleus centralis prosencephali; neocx Neocortex; neost Neostriatum; nop Nervus opticus; nubas Nucleus basalis; olfcx olfaktorischer Cortex; olfp olfaktorisches Pallium; p Pallium; P1-3 palliale Felder 1-3; palaeocx Palaeocortex; palaeosta Palaeostriatum augmentatum; palaeostp Palaeostriatum primitivum; pircx piriformer Cortex; plch Plexus choroideus (Adergeflecht); pros Prosencephalon; put Putamen; rhomb Rhombencephalon; se Septum; sp Subpallium; st Striatum; trolf Tractus olfactorius; v Ventrikel; Vd Pars dorsalis areae ventralis; Vl Pars lateralis area ventralis; vlat Ventriculus lateralis; Vv Pars ventralis areae ventralis.
Telencephalon
Abb. 2: Stark schematisierte Querschnitte durch die jeweils linke Hemisphäre des Telencephalons verschiedener Wirbeltiere; die Konturen der Ventrikel sind durch dickere Linien hervorgehoben. Farbcode und Abk. siehe Abb. 1 . Gebiete, deren Homologie unklar ist, sind weiß gelassen. Gebiete, die in ihrer Gesamtheit mehreren anderen Arealen anderer Tiere entsprechen, sind dem Farbcode entsprechend mehrfarbig. In manchen Fällen sind Strukturen, die tatsächlich in verschiedenen Querschnittsebenen liegen, in einer Ebene zusammengezogen.

Telencephalon
Abb. 3: Schema zur Erklärung der Hemisphärenrotation bei manchen Säugetieren (Primaten, Wale).
Oben ist eine Hirnanlage (Ansicht von links hinten oben) vor dem Einsetzen der Rotation abgebildet. Die generellen Lagebeziehungen sind identisch mit denen der übrigen Wirbeltiere. Der mediale Cortex (rot) liegt an der dorsalen Innenseite der Hemisphären, der laterale Cortex (blau) an der Außenseite. Die massive Expansion (schwarze Pfeile) des Neocortex (grün) bewirkt eine Wachstumsbewegung der Hemisphären, die sich beiderseits rückwärts, abwärts, und dann wieder vorwärts um den Hirnstamm winden (graue Pfeile).
Unten ist das Resultat anhand einer Seitenansicht der linken (links) und einer Innenansicht der Schnittfläche einer rechten Hemisphäre (rechts) dargestellt. Der Hirnstamm ist weggelassen. Als Resultat der Rotation der Hemisphären sind der Temporallappen und die Fissura lateralis (Sylvius-Furche) entstanden. Der "Drehpunkt" der Rotation (symbolisiert durch das Fadenkreuz) liegt in der Tiefe der Sylvius-Furche, in der Insula (Insel, siehe Abb. 4 ). Auch Strukturen im Innern der Hemisphäre, so z.B. Teile des Seitenventrikels (dessen Unterhorn) und Teile des Caudatums (dessen Schweif) werden von der Drehung erfaßt und in den Temporallappen verlagert. An der rechten Hemisphäre ist zu erkennen, daß sowohl der Balken (Corpus callosum) als auch der Fornix ihre Gestalt der Hemisphärenrotation verdanken. Der Hippocampus (der mediale Cortex) wird aus seiner ursprünglichen Lage in den Temporallappen gezogen, er gerät dort in die Nachbarschaft der olfaktorischen (ursprünglich lateralen) Cortices und der Amygdala. Auch diese wurden durch die Rotation von der Seitenfläche der Hemisphären an die vordere Innenseite des Temporallappens verlagert. Farbcode und Abk. siehe Abb. 1 .

Telencephalon
Abb. 4: Stark schematisierter Querschnitt durch die linke Hemisphäre eines menschlichen Telencephalons. Einige Strukturen an der Medialfläche des Schläfenlappens (olfaktorische Cortices, corticomediale Amygdala, Hippocampusformation), die tatsächlich in rostro-caudaler Reihenfolge hintereinander liegen, wurden auf eine gemeinsame Querschnittsebene projiziert. Man beachte die im Vergleich zum Oppossum ( siehe Abb. 2 , unten) durch die Hemisphärenrotation stark veränderten Lagebeziehungen. Farbcode und Abk. siehe Abb. 1 .
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.