Lexikon der Biologie: Membran
Membranw [von *membran- ], 1) Chemie: Trennwand in Gefäßen für die Osmose. Diaphragma, Pfeffer (W.F P.), Traube (M.). 2) allgemeine Biologie: dünnes Häutchen mit abgrenzender oder trennender Funktion, z.B. die Basalmembran (Basallamina), Befruchtungsmembran, Deckmembran. 3) Zellbiologie: Zellmembran, Biomembran, Einheitsmembran, integraler Bestandteil aller Zellen von Prokaryoten und Eukaryoten (Eucyte, Protocyte). Biologische Membranen sind hochselektive Permeabilitätsschranken (Permeabilität), die geschlossene Kompartimente (Kompartimentierungsregel) – ganze Zellen oder Organellen – aufbauen. Die physiologische Asymmetrie wird noch überlagert von einer strukturellen Ungleichheit beider Membranseiten. Deshalb nennt man zur eindeutigen Charakterisierung die dem Cytoplasma anliegende Membranseite P-Seite, die extraplasmatische Seite E-Seite. Im Querschnitt weisen alle Membranen bei optimaler Auflösung im Elektronenmikroskop eine trilamellare Struktur auf ( vgl. Abb. 1 ): einer zentralen hellen Linie (ca. 3 nm dick) liegt beidseitig eine elektronendichte Linie (jeweils 2 nm dick) an. Dieses elektronenmikroskopische Äquivalentbild der Biomembran ist als „unit membrane“ (Einheitsmembran) bekannt geworden. Die Grundstruktur einer Biomembran wird durch eine Doppelschicht (Bilayer;bimolekulare Lipidschicht) amphipolarer Lipide (Membranlipide, Phospholipide) gebildet (Lipiddoppelschicht), deren Dicke ca. 4 bis 5 nm beträgt. Dieses Bilayer stellt für die meisten wasserlöslichen Moleküle eine impermeable Barriere dar (Membrantransport). Andererseits sind die verschiedenartigen, für die einzelnen Membranarten und -funktionen charakteristischen Membranproteine in die Membran integriert (integrale Membranproteine) oder an sie angelagert (periphere Membranproteine). Entgegen früheren Vorstellungen weiß man heute, daß es keine Proteine gibt, die nur teilweise in die Lipiddoppelschicht reichen. Die quantitative Zusammensetzung von Biomembranen, d.h. der relative Anteil an Protein und Lipid, kann für Membranen unterschiedlicher Funktionen sehr verschieden sein. So sind die Myelinmembranen der Schwann-Zellen, welche die Axone der Nervenzellen als Isolation umgeben, besonders lipidreich (Proteinanteil nur ca. 20%), während bei der inneren Mitochondrienmembran (Mitochondrien), die eine Vielzahl von Membrantranslokatoren (s.u.), die Enzyme der Atmungskette sowie die ATP-Synthase (mitochondrialer Kopplungsfaktor) beinhaltet, die Proteine stark überwiegen (Proteinanteil ca. 75%). Anders als die Proteine haben die Membranlipide selten eine spezifische Funktion. Da sie aber die Grundsubstanz einer jeden Membran bilden, bestimmen sie auch im wesentlichen deren physikochemische Eigenschaften (Stabilität, Flexibilität, Semipermeabilität, Fluidität). Die Lipide bestehen aus einer polaren (hydrophilen) Kopfgruppe und einem unpolaren (hydrophoben) Schwanzteil, sind also amphipathische (amphiphile) Verbindungen ( vgl. Abb. 2 ). Den lipophilen, unpolaren Bereich bilden die Acylreste langkettiger Fettsäuren, typischerweise mit einer geraden Anzahl von Kohlenstoffatomen, deren wichtigste Vertreter die gesättigten Säuren Palmitinsäure (C 16:0), Stearinsäure (C 18:0), die einfach ungesättigte Ölsäure (C 18:1), die zweifach ungesättigte Linolsäure (C 18:2), die dreifach ungesättigte Linolensäure (C 18:3) sowie die vierfach ungesättigte Arachidonsäure (C 20:4) sind. Bei den Glycerophospholipiden (Phosphoglyceriden) sind die Fettsäuren über Esterbindungen am C-1 und C-2 des Glycerins gebunden, die C-3-Hydroxylgruppe ist dagegen mit Phosphorsäure verestert (es entsteht das Phosphatidat). Bei den Sphingolipiden steht anstelle des 1-Acylglycerins (Acylglycerine) ein über Amidbindungen gebundenes Sphingosin. Bei den Plasmalogenen (Acetalphosphatide) und den Lipiden der Archaebakterien können auch langkettige Alkohole über Etherbindungen an Glycerin gebunden sein (Phospholipide). Der polare Kopfteil besteht aus Phosphorsäureestern (mit verschiedenen Alkoholen) oder Zuckerresten, die elektrisch neutral bzw. positiv oder negativ geladen sein können. Die wichtigsten Phosphoglyceride sind Phosphatidyl-Ethanolamin, Phosphatidylserin, Phosphatidylinositol und Diphosphatidylglycerin (Cardiolipin). Die Membranbausteine Cholesterin und andere Sterine sind nicht nach diesem Prinzip aufgebaut. Hier wirkt eine Hydroxylgruppe als polarer Kopf. Die starre, planare Steroid-Ringstruktur sowie eine unpolare Kohlenwasserstoff-Schwanzgruppe sind im Membranverband zwischen die umgebenden Fettsäurereste eingelagert. Der Steroidring übt einen verfestigenden Effekt auf die ihm benachbarten Bereiche der Acylketten aus. Die integralen Proteine benötigen für ihre Funktionen, z.B. als Translokatoren oder Rezeptoren, die Umgebung der Lipide. Die Lipide gewährleisten die funktionell aktive Konformation von Membranproteinen. Sie bilden eine Art Solvathülle um die α-Helices (Alpha-Helix) der integralen Proteine und tragen so zur energetisch günstigen Konformation der ganzen Membran bei. Der Bereich zwischen den relativ starren Proteinen und den beweglichen Kohlenwasserstoffketten wird durch Membranlipide abgedichtet – eine wichtige Voraussetzung für die Semipermeabilität (Membranpermeabilität).
Membranmodelle ( vgl. Abb. 3 ): Lipiddoppelschichten stellen mehr oder weniger gute experimentelle Modellmembranen dar, in die der relativ große Proteinanteil der zellulären Membranen topologisch integriert werden muß. Das 1935 von J.F. Danielli und H. Davson entwickelte Membranmodell (Danielli-Davson-Modell) nimmt die Proteine als der Lipiddoppelschicht beidseitig aufgelagerte globuläre Partikel an. Röntgenbeugungsdaten (Proteinkristallisation, Röntgenstrukturanalyse), die mit den Myelin-Membranen der Schwannschen Zellen gewonnen wurden, unterstützten dieses Modell ebenso wie die elektronenmikroskopische Etablierung der „unit membrane“ (um 1960) durch J.D. Robertson. Die heutige Vorstellung von einer Biomembran als einer flüssig-kristallinen Lipiddoppelschicht, in der integrale Membranproteine lateral frei beweglich sind, basiert auf dem fluid mosaic model („Flüssig-Mosaik-Modell“), das S.J. Singer und G.L. Nicolson 1972 konzipierten. Einen wichtigen Beitrag zur Entstehung dieses Modells haben die Erkenntnisse aus der Gefrierbruch- und Gefrierätzelektronenmikroskopie geleistet (Gefrierätztechnik). Die Trennung der beiden Lipidschichten voneinander setzte mehr oder weniger strukturierte Flächen frei, und die weitere Analyse der auf den Bruchflächen zum Vorschein kommenden Erhebungen und Versenkungen (Durchmesser 5–10 nm) ergab, daß es sich um sog. Intra-Membran-Partikel, also Membranproteine, handelt.
Charakteristika der Lipid-Grundstruktur: Amphipolare Moleküle wie die Membranlipide neigen in wäßriger Umgebung zu übermolekularer Selbstorganisation (self assembly; vgl. Abb. 4 ). Je nach Lipidart organisieren sie sich zu Micellen, Doppelschichten oder invertierten Micellen (Emulgatoren). Phospholipide und Glykolipide sind als Schlüsselsubstanzen der Biomembran anzusehen, da sie spontan eine Doppelschicht ausbilden, die größere Dimensionen bis in den Millimeterbereich erreichen kann. (Aufgrund der sperrigen Fettsäureketten werden keine Micellen gebildet, deren Durchmesser gewöhnlich unter 20 nm liegt.) Bei der Ausbildung der Doppelschichten spielen hydrophobe Kräfte, van-der-Waals-Anziehungskräfte, elektrostatische Kräfte und Wasserstoffbrücken (Bindungen der polaren Köpfe mit Wassermolekülen aus der Umgebung) eine Rolle. In Lipiddoppelschichten gibt es wie in einer Biomembran den hydrophilen, stark hydratisierten Bereich und im Innern die relativ homogene Region der Kohlenwasserstoffketten, die durch viele, sich gegenseitig verstärkende, nichtkovalente Wechselwirkungen zusammengehalten werden. Konsequenzen dieses Zusammenhalts sind, daß Lipiddoppelschichten eine größere Ausdehnung anstreben, zum Zusammenschluß mit sich selbst neigen und selbstreparierend sind, da Defekte energetisch ungünstig sind. Dispergiert man Phospholipide in Wasser, so entstehen recht unterschiedliche Doppelschichtformen, die im Experiment häufig als Modellmembranen Verwendung finden: idealerweise recht homogene Einzelvesikel, sog.Liposomen, aber auch Myelinfiguren (komplex ineinandergeschachtelte Vesikel mit vielen übereinanderliegenden Doppelschichten). Bei Phospholipid-Doppelschichten kann man 2 Zustände unterscheiden ( vgl. Abb. 5 ): die sog. kristalline Phase, in der die Kohlenwasserstoffreste gestreckt und hexagonal angeordnet sind, und eine flüssig-kristalline Phase, bei der dieser hohe Ordnungsgrad aufgegeben wird und sich die Einzelmoleküle ziemlich frei in der Ebene des Bilayers bewegen können. Bei der sog. Übergangstemperatur (Phasenübergang) gehen die beiden Ordnungszustände ineinander über. Dieser endotherme Vorgang ist temperaturabhängig und läßt sich somit kalorimetrisch (Kalorimetrie) erfassen. Die Übergangstemperatur ist direkt abhängig von der Kettenlänge der Fettsäurereste in den Lipiden, von der Anzahl der Doppelbindungen (Grad der Desaturierung), aber auch vom polaren Rest des Moleküls. Die in den natürlichen Lipidmolekülen vorkommenden cis-Doppelbindungen – sie verursachen in der Acylkette einen Knick von ca. 30 ° – stören die für eine hexagonale Anordnung günstige gestreckte Molekülstruktur. Der kondensierende Effekt, den Sterine auf Phospholipidmembranen ausüben, kommt dadurch zustande, daß diese Moleküle oberhalb der Übergangstemperatur eine Streckung der benachbarten Kohlenwasserstoffketten der Phospholipidmoleküle bewirken und dadurch die Fluidität der Membran herabsetzen (Membranfluidität). Die Untersuchungen über Phasenübergänge in Modell- und Biomembranen sind für das Verständnis biologischer Membranen sehr wertvoll. In der lebenden Zelle spielen Phasenübergänge keine direkte Rolle, da sich hier die Membranlipide immer im flüssig-kristallinen Zustand befinden. Viele Zellen haben die Fähigkeit entwickelt, den Grad der Desaturierung der Membranlipide entsprechend der umgebenden Temperatur zu regulieren, d.h., bei tiefen Temperaturen nimmt der Desaturierungsgrad auf Kosten gesättigter Fettsäuren stark zu. – Die Beweglichkeit der Lipide ( vgl. Abb. 6 ) und Proteine in der flüssigen Biomembran läßt sich mittels Elektronenspinresonanz-Spektroskopie erfassen. Der Diffusionskoeffizient (Diffusion) von Lipiden in Membranen beträgt ca. 1 μm2s–1. Ein Phospholipid kann in 1 Sekunde eine Strecke von 2 μm überwinden, was etwa der Länge eines Bakteriums entspricht. Während der „Nachbarschaftsaustausch“ der Lipide mit 106 pro Sekunde sehr hoch liegt, ist die transversale Beweglichkeit – der Ortswechsel von einer Seite der Doppelschicht auf die andere (Flip-Flop) – ein sehr seltenes Ereignis; ein Phospholipidmolekül benötigt mehrere Stunden für ein Flip-Flop. Bei Membranproteinen, deren Energiebarriere für eine transversale Diffusion aufgrund der polaren Bereiche noch höher ist, wurde noch nie ein Flip-Flop beobachtet. Die Membranasymmetrie kann so über längere Zeiträume aufrechterhalten werden. – Membranen unterliegen wie alle Zellbestandteile einem ständigen turn over. Die Einzelkomponenten einer Membran haben dabei ganz verschiedene Halblebenszeiten, die etwa in der Hepatocyte der Ratte für Membranproteine bei 2 Tagen, für Lipide bei 1 Tag liegen, während die Zelle selbst ca. 4 Wochen lebt. Membranen können in der Zelle niemals de novo synthetisiert werden, sondern die Neusynthese von Membranmaterial und deren Einbau setzt immer das Vorhandensein bereits bestehender Membranen voraus, was auch die Aufrechterhaltung der strukturellen Asymmetrie sicherstellt. Für die cytoplasmatische Membran (intracytoplasmatische Membran, Cytoplasmamembran) werden die Proteine am rauhen endoplasmatischen Reticulum gebildet und dort direkt in die Membran eingebaut. Von dort gelangen die Membranproteine über einen Vesikelfluß (Membranfluß) in die übrigen cytoplasmatischen Membranen (Golgi-Membran, lysosomale Membran und Plasmamembran). Die Membranproteine der semiautonomen Organellen (Plastiden, Mitochondrien) werden, sofern sie nicht auf dem Organellengenom codiert sind, an freien 80S-Ribosomen synthetisiert, dann als Einzelmoleküle in die Organelle eingeschleust (posttranslationales processing: posttranslationale Proteinmodifikation) und schließlich in die entsprechenden Membranen integriert. Auch in Cytoplasmamembranen können Einzelmoleküle, z.B. Phospholipide, eingebaut werden. Dafür spricht auch die Existenz sog. Phospholipid-Carrier-Proteine (Carrier), die Phospholipide von einer Membran zur anderen transportieren können.
Plasmamembran: Ihrem grundsätzlichen Aufbau nach ist die Plasmamembran, die jede Zelle an ihrer Oberfläche begrenzt, eine typische Biomembran, die jedoch 2 strukturelle Besonderheiten aufweist. Eine Besonderheit der Plasmamembran ( vgl. Abb. 7 ) ist, daß ihre integralen Membranproteine zum größten Teil als Glykoproteine vorliegen, deren Oligosaccharidseitenketten ausschließlich auf der E-Seite der Membran liegen und die für eine Reihe von Funktionen (s.u.) unbedingt notwendig sind. Vorübergehend finden sich Glykoproteine und Glykolipide auch im endoplasmatischen Reticulum und im Golgi-Apparat, da sie hier gebildet werden und durch Vesikelfluß zur Plasmamembran gelangen. Bei der Untersuchung der exponierten Kohlenhydratanteile haben sich die Lectine – lösliche Proteine oder Glykoproteine meist pflanzlichen Ursprungs, die bestimmte Zuckerreste spezifisch binden können und damit als Markierungssubstanzen dienen können – besonders gut bewährt. Beispielsweise bindet Concanavalin A speziell an innere und nichtreduzierende α-Mannosylreste. Zu den Membran-Glykoproteinen zählen adhäsive Proteine (Adhäsine) wie das Fibronektin, das bei Interaktionen von Zellen mit Grund- oder Basalmembranen (Basallamina) oder nichtzellulären Bestandteilen des Bindegewebes eine wichtige Rolle spielt, Membranproteine, die als Translokatoren wirken, oder solche, die Rezeptorfunktionen (s.u.) haben. Glykoproteine werden als membranständige Antigene bezeichnet, wenn sie bei einem Fremdorganismus die Bildung von Antikörpern hervorrufen. Eine weitere Besonderheit der Plasmamembran ist die Wechselwirkung mit intrazellulären Strukturen wie dem Zellskelett mit seinen Actinfilamenten oder dem Membranskelett. – Die Plasmamembran zeichnet sich durch eine Reihe von besonderen Funktionen und Charakteristika aus: 1) Sie besitzt die Fähigkeit, auf bestimmte molekulare Signale von außen, wie Hormone, Neurotransmitter und Wachstumsfaktoren (die aufgrund ihrer Struktur die Membran nicht passieren können; Cytokine), zu reagieren. Dazu ist sie mit bestimmten Empfängern, in der Regel Glykoproteine, ausgestattet, um diese primären Botenmoleküle zu binden, nämlich den Membran-Rezeptoren. Einige dieser Rezeptoren zeigen eine Kinase-Domäne (Kinasen) mit ATP-Bindungsstelle im cytoplasmatischen Teil (Protein-Kinasen, Insulinrezeptor). Eine andere Gruppe von Rezeptoren weist eine Struktur aus mehreren Untereinheiten auf, die alle an der Ausbildung eines zentralen Ionenkanals beteiligt sind (Acetylcholinrezeptor). 2) Im Rahmen der Zell-Matrix-Erkennung stehen Zellen mit adhäsiven Proteinen der extrazellulären Matrix (z.B. Hyaluronsäure, Kollagene) in vielfältiger Wechselwirkung. Die Zellen weisen hierfür in den Plasmamembranen Glykoproteine oder Rezeptoren für Komponenten der extrazellulären Matrix auf (Adhäsine). 3) Zu den besonderen Aufgaben der Plasmamembran zählen Interaktionen mit anderen Zellen, d.h. alle Phänomene der Zell-Zell-Erkennung, seien es die Kontaktausbildung zu anderen Zellen, die Unterscheidung zwischen „Selbst“ und „Nicht-Selbst“, eine Aufgabe der Immunzellen (Immunsystem), oder komplizierte Vorgänge, die bei Entwicklungs- (Entwicklung, Embryonalentwicklung) und Differenzierungsprozessen (Differenzierung) eine Rolle spielen müssen. Zu diesen Vorgängen gehört auch die sog.Kontaktinhibition nichttransformierter Säugerzellen in Kultur. Neben den Blutgruppenantigenen auf der Plasmamembran der Erythrocyten spielt das HLA-System die wohl wichtigste Rolle für die immunologische „Selbst-Definition“ eines Individuums. Zell-Zell-Kontakte (Zell-Zell-Verbindungen) zwischen benachbarten Zellen bilden sich an besonders strukturierten Bereichen der Plasmamembranen aus. Diese besonders bei Höheren tierischen Organismen ausgeprägten Bereiche (cell-junctions) sind stabiler als die eher dynamischen Kontakte durch einzelne Adhäsionsmoleküle und manifestieren sich in Form von Multiproteinkomplexen (zum Teil unter Verwendung von Adhäsinen) auf 3 unterschiedliche Arten (mechanisch, physiologisch, kommunikativ): Als Desmosomen (Art von adhering junctions; Zelladhäsion) erfüllen sie im wesentlichen eine mechanische Funktion und gewährleisten den Zusammenhang größerer Zellverbände durch Adhäsion der Einzelzellen.tight-junctions sind besondere Zellkontakte zwischen Epithelzellen (Epithel), die dafür sorgen, daß das interzelluläre Milieu eines Organs vom externen Milieu vollständig abgetrennt wird, so daß eine interzelluläre Diffusion von Substanzen zwischen beiden Bereichen verhindert wird. Solche Verbindungen haben also eher eine physiologische Funktion. Meist werden die tight-junctions noch durch zusätzliche Desmosomen mechanisch verstärkt.gap-junctions bilden die dritte Kategorie interzellulärer Kontaktstellen über Plasmamembranen. Sie stellen direkte plasmatische Verbindungen zwischen benachbarten Zellen her, die Molekülen bis zu einer relativen Molekülmasse von etwa 1000 freien Durchtritt gewähren. Diese Kanäle dienen damit offenbar der Zellkommunikation, und es ist wahrscheinlich, daß auf diese Weise Botschaften (z.B. in Form von cAMP) zwischen Zellen ausgetauscht werden. Eine weitere Form von Zellkontakten stellen die Plasmodesmen der Pflanzenzellen dar, deren Durchmesser zwischen 30 und 50 nm liegen. Auch die Siebröhren im Phloem, die den Fern-Transport der Pflanzen ermöglichen (Assimilattransport), sind über Siebporen, die man als vergrößerte Plasmodesmen ansehen kann, miteinander verbunden (Leitbündel). 4) In besonderem Maße sind die Plasmamembranen Sitz wichtiger Translokator- bzw. Transportsysteme. Die Aufnahme partikulären bzw. gelösten Materials durch Vesikulationsvorgänge der Plasmamembran erfolgt durch Endocytose. Transportvorgänge durch die Plasmamembran unterscheiden sich prinzipiell nicht von jenen durch andere Biomembranen (Membrantransport, aktiver Transport), allerdings sind in den Plasmamembranen charakteristischerweise bestimmte ATPasen (Adenosintriphosphatasen) vorhanden – Translokatoren, die unter Verbrauch von ATP als spezifische Ionenpumpen fungieren und den zellulären Kationenhaushalt regulieren, z.B. die Na+-K+-ATPase (ATPase-Systeme, Natrium-Kalium-Pumpe), die im tierischen und menschlichen Organismus für die Ungleichverteilung von Na+- (Natrium) und K+-Ionen (Kalium) zwischen Cytoplasma und Außenmilieu sorgt, die Ca2+-ATPase, welche die cytoplasmatische Ca2+-Ionen-Konzentration (Calcium) niedrig hält (sarkoplasmatisches Reticulum), die H+-K+-ATPase (Protonenpumpe) in der luminalen Plasmamembran der Belegzellen im Magen, die wahrscheinlich den steilsten Ionen-Gradienten im Säugerorganismus überhaupt aufbaut (ca. 7 pH-Einheiten), und die H+-ATPase in der Plasmamembran von Hefen und Pflanzenzellen. Eine ähnliche Protonenpumpe in der lysosomalen Membran (Lysosomen) hält den intralysosomalen pH-Wert bei 4,5–5,0. Daneben kennt man auch spannungsabhängige und cAMP/cGMP-abhängige Ionenkanäle, Translokatoren für Anionen (Anionentranslokator) und Metabolite (Galactosid-Translokator, Glucose-Translokator). 5) Zwischen Cytoplasma und extrazellulärer Umgebung besteht häufig ein Membranpotential, das prinzipiell dadurch zustande kommt, daß Ionen auf den beiden Seiten der Membran ungleich verteilt sind. Seine Entstehung kann unterschiedliche Ursachen haben: Aktivität elektrogener Ionenpumpen, Donnan-Potential (Donnan-Verteilung) durch Festionen, Diffusionspotential durch unterschiedliche Permeabilität für verschiedene Ionen.
Die Plasmamembran der Bakterien(Bakterienmembran) unterscheidet sich im Aufbau kaum von der Höherer Organismen. In eine Phospholipiddoppelschicht eingelagert finden sich integrale Proteine mit speziellen katalytischen Funktionen; an beiden Oberflächen sind periphere Proteine angelagert. Lamellenartige Auswüchse der Membran nach innen sind für besondere Stoffwechselfunktionen verantwortlich. In der Plasmamembran von Prokaryoten spielt das sog. Phosphotransferase-System (aktiver Transport, Gruppentranslokation [Gruppenübertragung]) eine Rolle, dem 4 verschiedene Proteine angehören und dessen Energielieferant Phosphoenolpyruvat statt ATP (Adenosintriphosphat) darstellt. Es transportiert Zucker ins Cytoplasma, wo sie zu phosphorylierten Derivaten umgewandelt werden. Weitere Besonderheiten der Prokaryoten-Plasmamembran sind die Anheftung des Genoms/Nucleoids an ihrer Innenseite und die Tatsache, daß sie der Sitz der Enzyme der bakteriellen Atmungskette ist, deren eukaryotisches Äquivalent in der inneren Mitochondrienmembran lokalisiert ist. Bakterienzellwand, Biochemie (Geschichte der), Bioelektrizität, Biophysik, coated vesicles, Cytologie, Doppelmembran, Endomembransystem, Flippasen, Flüssig-Mosaik-Modell (Abb.), Hormone (Abb.), intracytoplasmatische Membranen, Ionenkanäle, Kernhülle, Membranenzyme, Membranfusion, Membranporen, Membran-Recycling, Naegeli (C.W. von), Purpurmembran, SNARE, Stop-Transfer-Sequenz, Thylakoidmembran, Transmembran-Facilitatoren, Transmembranhelices, Transportvesikel; Nervenzelle I–II, Zelle.
B.L./S.Kl.
Lit.:Alberts, B., Bray, D., Lewis, J., Raff, M., Roberts, K., Watson, J.D.: Molekularbiologie der Zelle. Weinheim 31995. Bielka, H., Börner, T.: Molekulare Biologie der Zelle. Jena 1995. deDuve, C.: Die Zelle. Expedition in die Grundstruktur des Lebens. Heidelberg 1993. Gennis, R.B.: Biomembranes. Berlin 1989. Kleinig, H., Maier, U.: Zellbiologie. Stuttgart 41999. Lodish, H., Baltimore, D., Berk, A., Zipusky, S.L., Matsudaira, P., Darnell, J.: Molekulare Zellbiologie. Berlin 21996. Yeagle, P.L.: The membranes of cells. Orlando 21993.
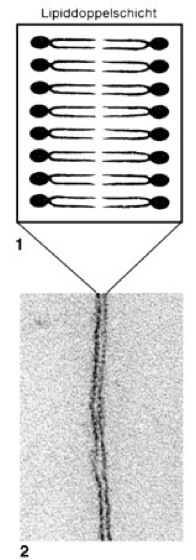
Membran
Abb. 1:
1 Strukturelles Grundelement aller Biomembranen ist eine Doppelschicht aus amphipolaren Lipidmolekülen (Lipiddoppelschicht). Ovale symbolisieren polare Kopfgruppen (Phosphatgruppen und polare Reste), „Schwänze“ unpolare Schwanzgruppen aus Fettsäureresten. 2 Elektronenmikroskopische Aufnahme einer Biomembran mit der typischen trilamellaren Struktur („unit membrane“): 2 etwa 2 nm dicke dunkle Linien schließen eine ca. 3 nm dicke helle Linie ein.

Membran
Abb. 2:
Aufbau der Phospholipide (Membranlipide).
1a Strukturformel, 1b raumfüllendes Kalottenmodell des Phospholipids Lecithin (Phosphatidylcholin). Beim Molekül 2 wurde in die Kohlenwasserstoffkette eine cis-Doppelbindung eingeführt, was zu einer Abknickung des betreffenden „Beins“ um etwa 30 führt. Während die unpolaren Fettsäureschwänze durch hydrophobe Wechselwirkungen untereinander die Ausbildung von Lipiddoppelschichten ermöglichen, bilden die polaren Reste Hydrathüllen zum umgebenden wäßrigen Medium aus, da dort die Ausbildung von Wasserstoffbrücken nicht eingeschränkt ist.
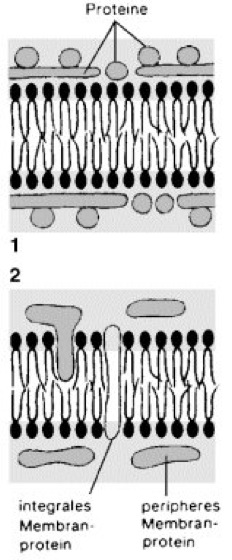
Membran
Abb. 3:
Stark vereinfachte Membranmodelle:1 Danielli-Davson-Modell (mit Modifikationen). 2 „fluid mosaic“ model von Singer und Nicolson. Während die alte Vorstellung die Membranproteine als beidseitig an die Lipiddoppelschichten adsorbierte globuläre Partikel annahm, revolutionierte das fluid mosaic model mit der Vorstellung, daß Membranproteine lateral frei in der Lipiddoppelschicht „schwimmen“, ja diese sogar durchdringen können, und sich die gesamte Struktur der Membran nicht in einem starren, sondern in einem äußerst fluiden und dynamischen Zustand befindet.

Membran
Abb. 4:
Selbstorganisation von Lipiden (self assembly).
Ähnlich wie Detergentien (Membranproteine) neigen auch Membranlipide in wäßriger Umgebung zur Ausbildung übermolekularer Strukturen. 1Phospholipide ordnen sich auf einer Wasseroberfläche so an, daß die polaren Gruppen zum Wasser hin, die Fettsäureschwänze vom Wasser abgewandt orientiert sind. 2 Innerhalb einer wäßrigen Phase lagern sie sich zu Doppelschichten zusammen, mit den hydrophoben Bereichen nach innen. 3 Solche Doppelschichten liegen aus energetischen Gründen nie als Lamellen vor, sondern immer als geschlossene Vesikel, die, wie Biomembranen, geschlossene Kompartimente aufbauen (Kompartimentierungsregel). Relativ homogene Populationen solcher Lipidvesikel stellen die Liposomen dar.

Membran
Abb. 5:
Bei der Lipiddoppelschicht lassen sich 2 Zustände unterscheiden: 1 Die kristalline Phase ist durch gerade ausgerichtete gesättigte Fettsäurereste in hexagonaler Anordnung gekennzeichnet. 2Flüssig-kristalline Phase: die Einführung von cis-Doppelbindungen in die Fettsäureketten (geknicktes „Bein“) hebt den hohen Ordnungsgrad auf: die Membranfluidität nimmt zu.
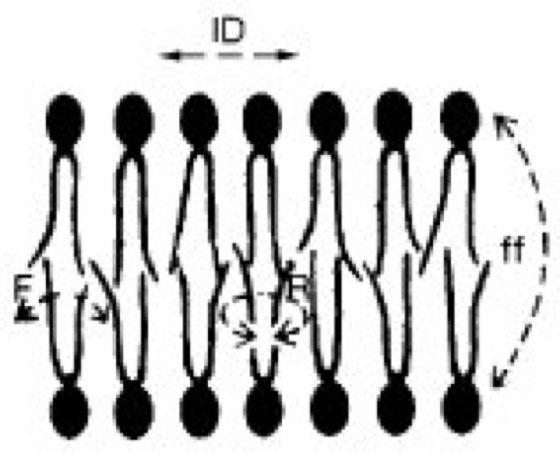
Membran
Abb. 6: Verschiedene Bewegungsmöglichkeiten amphipolarer Membranlipide. F Flexibilität der Acylreste, ff Flip-Flop (sehr selten), lD laterale Diffusion, R Rotation

Membran
Abb. 7: Schematische Darstellung einer Plasmamembran, auf deren E-Seite die Membranproteine (2, 3) Oligosaccharidseitenketten exponiert haben; hier finden sich auch viele Glykolipide (1). Die zwischen die amphipolaren Membranlipide eingelagerten relativ starren Sterinmoleküle (z.B. Cholesterin, 6) üben einen kondensierenden Effekt aus. Sie reichen etwa 0,9 nm weit in die Doppelschicht hinein. Spezialisierte Translokator-Proteine (3), die häufig aus Oligomeren aufgebaut sind, vermitteln den Transport von Metaboliten oder Ionen zwischen extraplasmatischem Raum und Cytoplasma. Wo die integralen Membranproteine die Membran durchdringen, bestehen hydrophobe Wechselwirkungen mit den Membranlipiden. In diesem hydrophoben Bereich überwiegen unpolare Aminosäuren in der Polypeptidkette. Integrale Membranproteine können auch über kovalent gebundene Fettsäurereste (Lipophilin) in der Membran verankert werden (4). Periphere Membran-assoziierte Proteine (5) können über nicht-kovalente Interaktionen an integrale Membranproteine gebunden sein. Die Nomenklatur für die 4 Ansichten einer Membran (die beiden äußeren Oberflächen ES und PS einschließlich ihrer Bruchflächen EF und PF) stammt aus der Gefrierbruch-Elektronenmikroskopie (Gefrierätztechnik). Sie erlaubt die eindeutige Zuordnung z.B. der mit dieser Methode sichtbar gemachten Membranproteine.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.