Lexikon der Biochemie: Xanthin-Oxidase
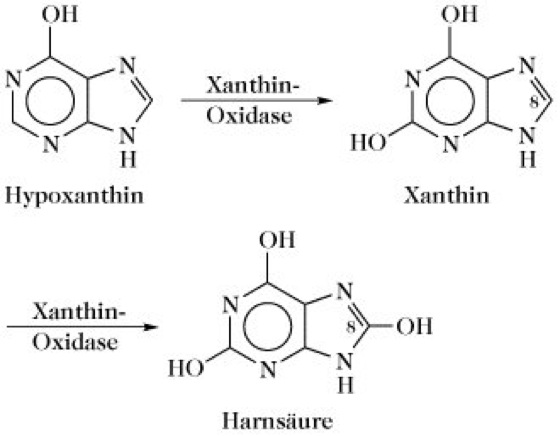
Xanthin-Oxidase, Xanthin-Dehydrogenase, Schardinger-Enzym, ein zu den Eisen- und Molybdän-haltigen Flavinenzymen zählendes dimeres Enzym des aeroben Purinabbaus, das Hypoxanthin und Xanthin zu Harnsäure oxidiert (Abb. 1): Hypoxanthin + H2O + O2 → Xanthin + H2O2; Xanthin + H2O + O2 → Harnsäure + H 2O2. Es ist ein dimeres Enzym, Mr 275kDa, pH-Optimum 4,7, pI 5,35, enthält 2FAD, 2Mo und 8Fe (X. aus Milch). X. hat nur geringe Substratspezifität, da auch andere Purine, z.B. Adenin, aliphatische und aromatische Aldehyde, Pyrimidine, Pteridine und andere heterozyklische Verbindungen oxidiert werden. Ein Mangel an X. bewirkt die Ausbildung einer Xanthinurie.
X. ist in tierischen Geweben innerhalb des Golgi-Apparats lokalisiert und kommt außer in Kälberleber besonders reichlich in der Milch (hier als Sekretenzym) vor, wo sie zur Unterscheidung frischer, nicht erhitzter Milch von erhitzter oder pasteurisierter Milch dient.
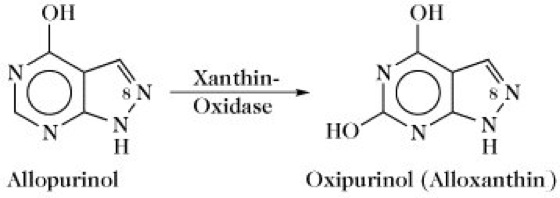
X. und Xanthin-Dehydrogenase werden gelegentlich als unterschiedliche Enzyme betrachtet, wobei mit X. das ursprüngliche Schardinger-Enzym aus der Milch (EC 1.2.3.2) und mit Xanthin-Dehydrogenase ein Enzym aus der Hühnerleber (EC 1.2.1.37) gemeint ist. Diese beiden Enzyme sowie die Aldehyd-Oxidase (EC 1.2.3.1) haben eine sehr große Ähnlichkeit bezüglich ihrer Zusammensetzung und vermutlich ihres Katalysemechanismus, unterscheiden sich jedoch in der Substratspezifität. Die X. fungiert praktisch als ein Mini-Elektronentransportprotein. Das Dimer mit identischen Untereinheiten (Mr 130 kDa) ist bei Säugern nahezu ausschließlich in der Leber und der Dünndarmschleimhaut lokalisiert. Beide Untereinheiten enthalten ein FAD, einen zwischen den Oxidationsstufen Mo(VI) und Mo(IV) sich hin und her bewegenden Molybdän-Komplex und zwei unterschiedliche Fe-S-Zentren. Der sehr komplexe Katalysemechanismus beginnt mit einem Angriff des Enzym-Nucleophils auf das C(8)-Atom des Xanthins, wobei das dort gebundene H-Atom als Hydridion eliminiert wird. Letzters verbindet sich mit den Mo(VI)-Enzym-Komplex. Nach der Reduktion zum Mo(IV) wird das Enzym-Nucleophil durch Wasser attackiert, wobei unter Freisetzung eines Protons Harnsäure entsteht. Der reduzierte Enzym-Mo(IV)-Komplex wird durch O2 wieder zum Enzym-Mo(VI)-Komplex reoxidiert. Hierbei werden Elektronen vom Mo(IV) zu den anderen Redoxzentren des Mini-Elektronentransportproteins geschleust und letztendlich vom Flavin auf O2 transferiert. Das dabei gebildete toxische H2O2 wird durch Katalase zu H2O und O2 zerlegt. Ein kompetitiver Inhibitor der X. ist ein Isomer des Hypoxanthins, das anstelle der CH(8)-Gruppierung ein N-Atom enthält. Das als Allopurinol (Abb. 2) bezeichnete Uricostatikum hemmt ebenso wie sein Oxidationsprodukt Oxipurinol (Alloxanthin) die X. und wird zur Behandlung der Gicht eingesetzt, die durch einen Harnsäureüberschuss verursacht wird.
Schreiben Sie uns!