Lexikon der Chemie: Spektrum
Spektrum, im weiteren Sinne die Anordnung einer Intensitätsverteilung als Funktion bestimmter Eigenschaftswerte, z. B. die Angabe der Häufigkeit von Masseteilchen in Abhängigkeit von ihrer Masse im Massenspektrum, Energiespektrum oder Geschwindigkeitsspektrum, im engeren Sinne die Intensitätsverteilung elektromagnetischer Strahlung in Abhängigkeit von ihrer Frequenz, Wellenlänge oder Wellenzahl (elektromagnetisches Spektrum). S. werden häufig graphisch dargestellt, wobei zur Angabe der Intensität unterschiedliche Einheiten (Durchlässigkeit, Absorption, Extinktion, molarer Extinktionskoeffizient, relative Häufigkeit u. a.) verwendet werden können. S. können nach ähnlichen Gesichtspunkten wie die Spektroskopie eingeteilt werden, z. B. Reflexionsspektren, Infrarotspektren, Mößbauer-Spektren.
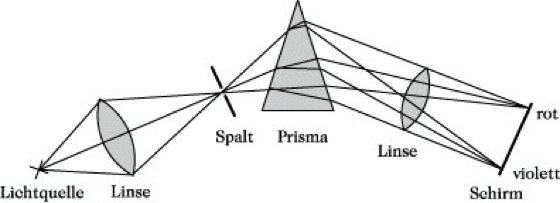
Spektrum. Abb.: Spektrale Zerlegung von sichtbarem Licht.
Ursprünglich bezeichnete man das Farbband, das durch Zerlegen von sichtbarem Licht in die einzelnen Spektralfarben entstand, als S. Läßt man z. B. Licht einer Bogenlampe durch eine Sammellinse auf einen Spalt treffen, der sich im Brennpunkt der Linse befindet, und bildet man diesen Spalt mit Hilfe einer zweiten Sammellinse auf einem Schirm ab, nachdem das Licht hinter dem Spalt durch ein Prisma gegangen ist, so erhält man nicht ein weißes Bild des Spaltes, sondern ein breites farbiges Band, das sich von Rot, Orange, Gelb, Grün, Indigo nach Violett erstreckt (Abb.). Der Strahlengang wird dabei aus einer ursprünglichen Richtung abgelenkt, wobei die Ablenkung von Rot nach Violett zunimmt. Auf diese Weise entsteht das S. der Lichtquelle. Die genannten Spektralfarben unterscheiden sich in ihren Wellenlängen bzw. Frequenzen, wobei die rote Grenze des sichtbaren S. bei 770 nm, die violette bei 400 nm zu finden ist. Wichtig ist die Unterscheidung zwischen Emissions- und Absorptionsspektren. Die ersteren entstehen durch Abgabe, die zweiten durch Aufnahme von Energie in Form elektromagnetischer Strahlung. Glühende feste und flüssige Körper senden ein kontinuierliches Emissionsspektrum aus, das über einen größeren Spektralbereich alle Wellenlängen enthält. Glühende Dämpfe und Gase, die durch Energiezufuhr zum Leuchten gebracht wurden, emittieren entweder Linien- oder Bandenspektren, je nachdem, ob Atome (Atomspektren) oder Moleküle (Molekülspektren) für die Lichtemission verantwortlich sind. Linienspektren bestehen aus einer mehr oder weniger großen Anzahl einzelner Spektrallinien. Bandenspektren bestehen auch aus einzelnen Linien, die jedoch dicht gehäuft erscheinen und deutlich unterscheidbare Gruppen (Banden) bilden.
Verdampft man ein Stück Natrium in einer Bunsenflamme, so sendet der glühende Natriumdampf ein Emissionsspektrum aus. Es besteht vorwiegend aus der "gelben Natriumlinie" bei 589 nm, die man mit einem Spektroskop (Spektralapparaturen) als leuchtende gelbe Linie auf dunklem Hintergrund erkennen kann. Schickt man dagegen weißes Licht von einer Bogenlampe durch den glühenden Natriumdampf und betrachtet das S. im Spektroskop, so erkennt man ein kontinuierliches Farbband, in dem an der Stelle der gelben Natriumlinie eine schwarze Linie erscheint. Der Natriumdampf hat die für ihn charakteristische Wellenlänge aus dem weißen Licht aufgenommen. Das so entstandene Absorptionsspektrum kann als das "Negativ" des Emissionsspektrums betrachtet werden. Das bekannteste Absorptionsspektrum ist das Sonnenspektrum mit einer Vielzahl nach dem Optiker Fraunhofer benannter dunkler Linien. Der glühende Sonnenkern emittiert ein kontinuierliches S., aus dem die in der Gashülle der Sonne enthaltenen Substanzen die für sie charakteristischen Wellenlängen absorbieren.
Schreiben Sie uns!