Lexikon der Biochemie: L-Histidin
L-Histidin, His, Imidazolylalanin, eine proteinogene, halbessenzielle Aminosäure; Mr 155,2Da, F. 277°C (Z.), [α]
![]()
= +11,8° (c = 2 in 5M Salzsäure) oder -38,5° (c = 2, Wasser). His ist bei vielen Enzymen Bestandteil des katalytischen Zentrums und ist auch Baustein von Carnosin und Anserin. Es ist schwach glucoplastisch. In Abwesenheit von His kann das erwachsene Tier sein Stickstoffgleichgewicht für kurze Zeit erhalten; für das wachsende Tier ist es jedoch unbedingt erforderlich. Der Imidazolring kann durch Säugetiere nicht synthetisiert werden. His wird über Imidazolglycerinphosphat im terminalen Teil (Abb. 1b) des ATP-Imidazol-Zyklus (Abb. 2) gebildet. Bei dieser Biosynthese wird Phosphoribosyl-Formimino-aminoimidazolcarboxamidribotid durch eine im Zellstoffwechsel relativ seltene Amadori-Umlagerung gebildet. Es ist bemerkenswert, dass ATP als Substrat dient. In das His werden nur das C-2-Atom und das N-1-Atom des Purinrings eingebracht (Abb. 1a). His wird durch Histidase zu Urocaninsäure (Imidazolacrylsäure) abgebaut und weiter über Imidazolonpropionsäure und Formiminoglutaminsäure zu Glutaminsäure metabolisiert (Abb. 3). Die intermediär gebildete Formiminogruppe wird zur Synthese aktiver Einkohlenstoff-Einheiten verwendet. His wird zur Behandlung von Allergien und Anämien verwendet. Im Labor ist His ein nützlicher Puffer im physiologischen pH-Bereich. [R.G. Martin et al. Methods in Enzymology XVII B (1971) 3-44; M. Brenner u. B.N. Ames "The Histidine Operon and Its Regulation" in Greenberg (Hrsg.) Metabolic Pathways (3. Ausg.) 5, 349-387]
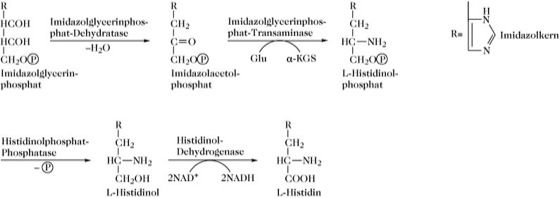
b) Terminale Reaktionen der Histidinbiosynthese.
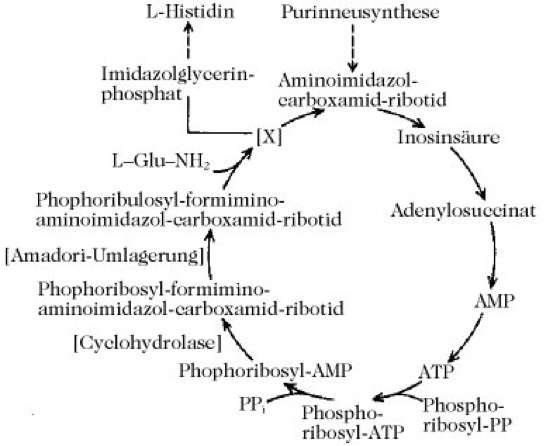
Abb. 2. L-Histidin. Der ATP-Imidazol-Zyklus. Der letzte Teil dieses Zyklus wird im Detail in Abb. 1a gezeigt.
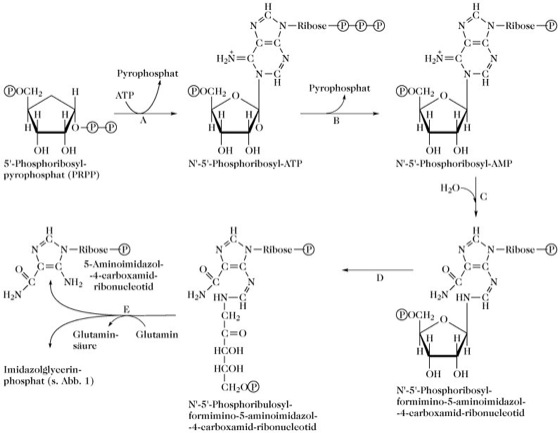
Abb. 1. L-Histidin. a) Die ersten Schritte der Imidazolbiosynthese.
A: N-1-(5'-Phosphoribosyl)adenosintriphosphat:Pyrophosphatphosphoribosyl-Transferase, bzw. ATP-Phosphoribosyl-Transferase (EC 2.4.2.17).
B: Phosphoribosyl-ATP-Pyrophosphohydrolase (EC 2.4.2.17). In Neurospora ist dieses Enzym trifunktional und katalysiert auch die Reaktion A und die Umwandlung von Histidinol in Histidin (Abb. 1b).
C: 1-N-(5'-Phospho-D-ribosyl)-AMP-1,6-Hydrolase, bzw. Phosphoribosyl-AMP-Cyclohydrolase (EC 3.5.4.19).
D: Amadori-Umlagerung des Phosphoribosylrests.
E: Amidotransferase und Cyclase. Vermutlich wird durch die Übertragung von Stickstoff aus Glutamin eine Zwischenstufe gebildet, aus der dann durch Zyklisierung der Imidazolring von Imidazolglycerinphosphat hervorgeht. Die Zwischenstufe ist nicht bekannt und die Amidotransferase- und Cyclaseaktivitäten konnten noch nicht voneinander getrennt werden.
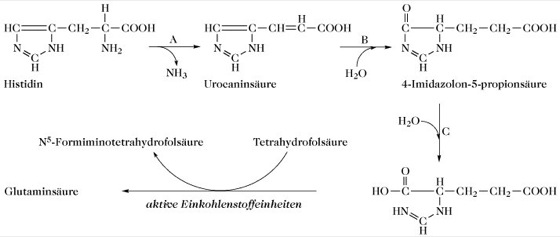
Abb. 3. L-Histidin. Biochemischer Abbau von Histidin.
A: L-Histidinammoniak-Lyase (Histidase; EC 4.3.1.3).
B: 4-Imidazol-5-propionat-Hydrolyase (Urocanase; EC 4.2.1.49).
C: Imidazolon-5-propionat-Amidohydrolase (EC 3.5.2.7).
Schreiben Sie uns!