Lexikon der Chemie: Chlorphenole
Chlorphenole, Monochlorphenole, drei isomere Phenolderivate.
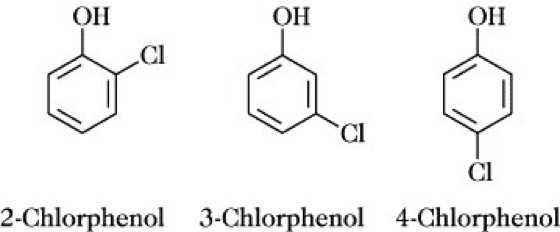
2-Chlorphenol, eine farblose, unangenehm riechende Flüssigkeit; F. 9 °C, Kp. 174,9 °C, nD20 1,5524. Es entsteht bei der Umsetzung von Phenol mit Chlor oder Sulfurylchlorid neben 4-Chlorphenol, von dem es durch Vakuumdestillation abgetrennt wird. Bei Einwirkung von überschüssigem Chlor entstehen vorrangig 2,4-Dichlorphenol und 2,4,6-Trichlorphenol. 2-Chlorphenol wird zur Herstellung von Brenzcatechin verwendet. 3-Chlorphenol, nadelförmige Kristalle; F. 33 °C, Kp. 214 °C, nD40 1,5565. Man erhält es aus 3-Chloranilin durch Diazotierung und Verkochen des Diazoniumsalzes. 4-Chlorphenol, farblose, nadelförmige Kristalle mit charakteristischem phenolähnlichen Geruch; F. 43,7 °C, Kp. 219,8 °C, nD40 1,5579. Man gewinnt es mit relativ hohem Anteil bei der Umsetzung von Phenol mit Sulfurylchlorid bei 25 °C. Es kann zu Hydrochinon weiterverarbeitet werden.
Die C. sind in Wasser wenig löslich, gut dagegen in Ethanol und Ether und in wäßriger Alkalihydroxidlösung. Sie sind Zwischenprodukte für die Herstellung von Farbstoffen und werden als Desinfektionsmittel verwendet. Ihre Säurestärke und ihr antiseptischer Charakter sind größer als die des Grundkörpers Phenol.
Dichlorphenole, sechs isomere Phenolderivate, von denen das leicht zugängliche 2,4-Dichlorphenol Bedeutung zur Herstellung der 2,4-Dichlorphenoxyessigsäure erlangt hat. 2,4-Dichlorphenol, farblose Nadeln; F. 45 °C, Kp. 210 °C. Es entsteht bei der Umsetzung von Phenol mit überschüssigem Chlor oder auch Sulfurylchlorid. Als Nebenprodukt fällt 2,6-Dichlorphenol an (F. 68 bis 69 °C, Kp. 219 °C). Technisch wichtig ist die Umsetzung von Dichlorphenolen in alkalischer Lösung mit Chloressigsäure zu Herbiziden. Weiterhin werden die C. als Mottenschutzmittel eingesetzt.
Schreiben Sie uns!