Gentherapie mit CRISPR/Cas9: Hält die »Genschere«, was sie verspricht?
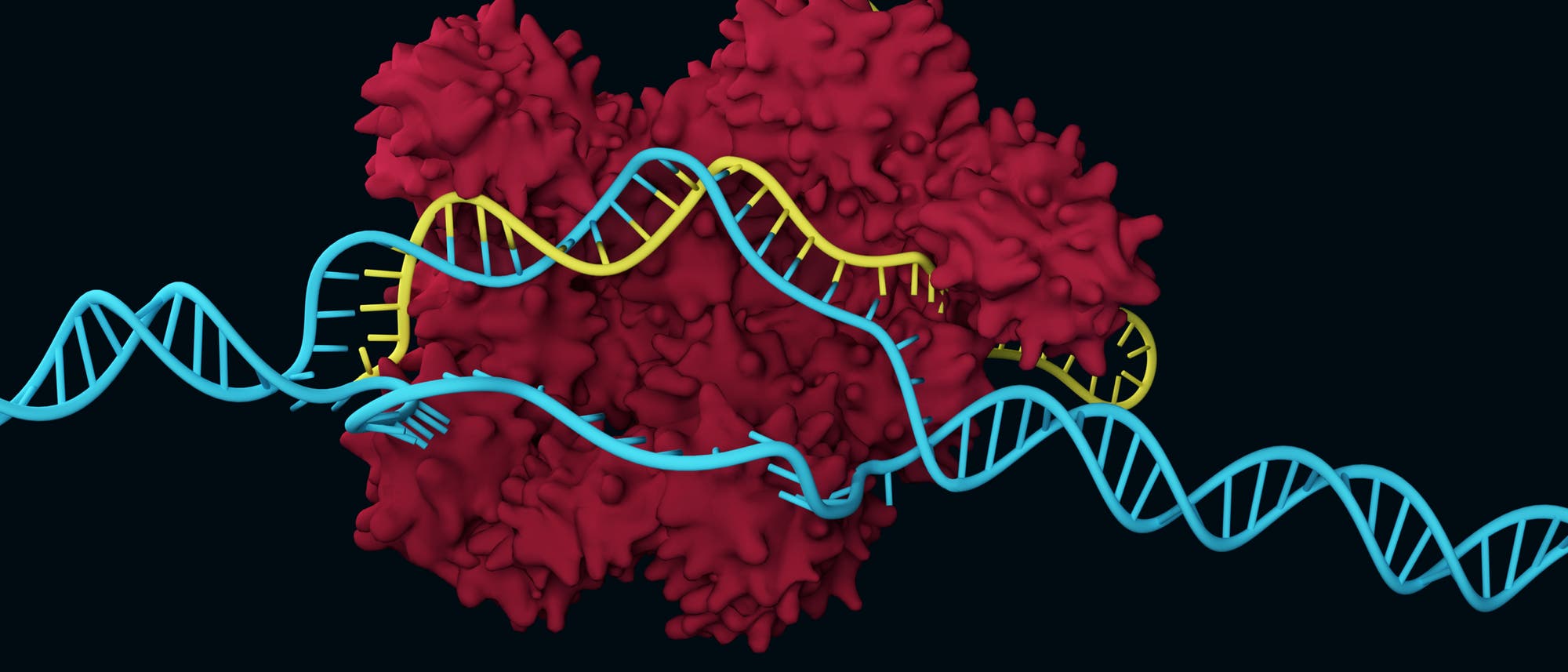
Die »Genschere« CRISPR/Cas9 feiert dieses Jahr ihren zehnten Geburtstag. 2012 hatten Emanuelle Charpentier und Jennifer Doudna ihre Entdeckung veröffentlicht, 2020 wurden sie dafür mit dem Nobelpreis geehrt. Das ursprünglich bakterielle Schneidprotein avancierte in kürzester Zeit zu einem Routinewerkzeug der Forschung. Es erlaubt Wissenschaftlern das Erbgut schnell und einfach gezielt zu schneiden und das in allen Organismen.
Die Genschere hat damit auch diverse Hoffnungen neu entfacht. Etwa jene auf eine funktionierende Gentherapie. Die Idee dahinter ist bestechend einfach: Vielen Krankheiten liegt ein Genfehler zu Grunde, eine so genannte Mutation, die das entsprechende Protein funktionslos macht. Bei der klassischen Gentherapie versucht man das fehlerhafte Gen durch ein intaktes zu ersetzen, so dass die Zelle wieder in der Lage ist, das Protein korrekt zu produzieren.
CRISPR/Cas9 soll einen noch präziseren Eingriff ermöglichen, indem Erbgutdefekte direkt vor Ort repariert werden, und damit eine gänzlich neue Ära der Medizin einläuten. »In den vergangenen Jahren wurden gute Fortschritte erzielt«, sagt Toni Cathomen, Direktor des Instituts für Transfusionsmedizin und Gentherapie der Universität Freiburg. Doch je näher man sich dem Ziel wähnt, desto deutlicher werden die bestehenden Herausforderungen.
Frisches Blut dank gelöster Blockade
Die WHO listet in ihrer Gentechnik-Datenbank »Human Genome Editing Registry«aktuell 139 klinische Studien auf. Grundsätzlich unterscheidet man Ex-vivo-Verfahren, bei denen Patienten Zellen entnommen und im Labor korrigiert werden, von In-vivo-Verfahren, bei denen die Genkorrektur direkt im Körper erfolgt. Das Spektrum möglicher Anwendungen ist groß und reicht von geneditierten Immunzellen gegen Krebs bis zur Therapie seltener und oft unheilbarer Erbkrankheiten. Am weitesten fortgeschritten ist die Behandlung gegen angeborene Bluterkrankungen wie Sichelzellanämie und β-Thalassämie, bei denen der Körper auf Grund eines Genfehlers zu wenig funktionstüchtiges Hämoglobin bildet, das für den Sauerstofftransport im Blut zuständig ist.
»Der Patientin geht es gut, die Therapie war erfolgreich«Selim Corbacioglu, Universitätsklinikum Regensburg
Die Zwischenergebnisse der ersten CRISPR-basierten Gentherapie stimmen positiv: Ende 2019 wurde die erste ß-Thalassämie-Patientin am Universitätsklinikum Regensburg behandelt. »Der Patientin geht es gut, die Therapie war erfolgreich«, sagt Selim Corbacioglu, Leiter der dortigen Abteilung für Pädiatrische Hämatologie, Onkologie und Stammzelltransplantation. Auch vier weiteren in Regensburg behandelten Patienten hat die Therapie geholfen. Sie sind nicht mehr länger abhängig von monatlichen Bluttransfusionen und müssen nicht länger auf einen geeigneten Blutstammzellspender hoffen, denn ihr Körper wird nun mit ausreichend fetalem Hämoglobin versorgt.
Das gelingt mit einem Trick: Das Gen für fetales Hämoglobin ist während der Schwangerschaft aktiv, wird einige Zeit nach der Geburt aber durch ein Protein stillgelegt. Mit Hilfe der Genschere heben Ärzte die Blockade auf, so dass der Körper das fetale Hämoglobin-Protein wieder herstellt. Der eigentliche Gendefekt wird also nicht repariert, sondern ein Ersatzgen reaktiviert.
Die CRISPR-Gentherapie an Zellen außerhalb des Körpers (ex vivo) hat allerdings die gleichen schweren Nebenwirkungen wie die konventionelle Stammzelltransplantation auch: Nachdem man den Patienten Blutstammzellen entnommen hat, um sie im Labor zu editieren, benötigen sie eine Chemotherapie, um die defekten, blutbildenden Zellen zu zerstören. »Damit ist fast unweigerlich auch ein Fertilitätsverlust verbunden«, sagt Corbacioglu. Hinzu komme, dass man die Spätfolgen einer Gentherapie noch nicht adäquat beurteilen könne.
Gentherapie im Körper
Der nächste CRISPR-Gentherapie-Versuch – diesmal im Körper selbst – folgte 2020 im Auge. Das Auge ist besonders gut für Gentherapien geeignet, weil es ein leicht zugängliches und abgeschlossenes Organ ist. Behandelt wurde je ein Auge von fünf Patienten, die an einer Form der Lebersche Amaurose leiden. Diese Erkrankung, führt schon früh zur Erblindung, weil ein Gendefekt zu fehlgeformten Fotorezeptoren führt. Die »Genschere« schneidet die Mutation heraus, so dass sich das Fotorezeptor-Protein wieder korrekt ausbilden kann.Die Zwischenergebnisse der Studie wurden im Herbst 2021 auf einem Kongress veröffentlicht: Zwei von fünf Patienten berichteten über eine Verbesserung ihrer Sehfähigkeit. Das Urteil der wissenschaftlichen Gemeinschaft fiel gemischt aus. Momentan werden weitere Patienten mit einer höheren Dosis behandelt und auch Jugendliche bei denen die Krankheit möglicherweise noch nicht so weit fortgeschritten ist. Weitere Ergebnisse werden im Herbst erwartet.
2021 folgte die nächste Anwendung, die das Fachmagazin »Science« zu einem »Durchbruch des Jahres 2021« kürte: 15 Patientinnen und Patienten mit der seltenen Erkrankung Transthyretin-Amyloidose haben die CRISPR-Gentherapie mittlerweile per Spritze erhalten – direkt in die Blutbahn. Bei ihnen ist das TTR-Protein aufgrund einer Mutation im entsprechenden Gen fehlgefaltet. Es wird in der Leber gebildet und ins Blut abgegeben, verklumpt und reichert sich vor allem im Herzen und im Nervensystem an, was zu Missempfindungen, Schmerzen und Muskelschwäche führt. Die Genschere zerschneidet das TTR-Gen, so dass die Konzentration des Proteins um bis zu 93 Prozent sinkt.
Kaputtmachen ist einfacher
Im Februar gaben die an der Studie beteiligten Unternehmen bekannt, dass die Wirkung der einmaligen Leber-Gentherapie auch nach einem Jahr noch anhält. Noch ist aber unklar, ob sich das Fortschreiten der Krankheit stoppen oder sogar umkehren lässt.
»Was wir momentan über alle Studien hinweg erkennen, ist, dass das Kaputtschneiden von Genen viel einfacher funktioniert als das Reparieren«, sagt Cathomen. CRISPR/Cas9 schneidet die DNA zuverlässig am Wunschort und zwar beide Stränge des DNA-Fadens. Die Reparatur des Schnitts übernimmt aber die Zelle. Sie hat dafür zwei Möglichkeiten: Meist verknüpft sie die beiden losen Enden eines DNA-Fadens recht nachlässig wieder miteinander, das heißt, es entstehen Fehler. Fehler in einem Gen führen in der Regel zu einem funktionsuntüchtigen Protein – was bei manchen Gentherapien zum Ziel führt. »Die meisten genetischen Erkrankungen können allerdings nur therapiert werden, indem der Gendefekt korrekt repariert wird«, betont Cathomen.
»Wie sicher die Technik ist, werden wir erst in ein paar Jahren wissen«Toni Cathomen, Universität Freiburg
Mit dem zweiten, präziseren Reparaturmechanismus der Zelle kann das gelingen. Er funktioniert aber nur in sich teilenden Zellen und ist insgesamt seltener aktiv als die nachlässige Variante. »Die Frage ist, ob und wie sich die genaue Reparatur aktivieren lässt«, so Cathomen.
Mit dem Schneiden ist auch ein grundsätzliches Sicherheitsrisiko verbunden, denn ab und an schneidet die Genschere daneben. Wissenschaftler befürchten, dass diese sogenannte Off-Target-Aktivität krebsauslösende Mutationen erzeugen könnte. »Ganz ohne Off-target-Effekte wird es nicht gehen«, sagt Cathomen, »aber nicht jeder Fehlschnitt ist automatisch problematisch.« Jeder Mensch häufe im Laufe seines Lebens Mutationen an, das sei ein natürlicher Prozess. »Die Studienteilnehmer werden regelmäßig untersucht, aber wie sicher die Technik ist, werden wir erst in ein paar Jahren wissen.«
Kann man Fehler einfach hinnehmen?
Möglicherweise müssen off-target-Effekte auch hingenommen werden: »Es kommt auf die Erkrankung und die zur Verfügung stehenden Therapien an«, erklärt Gerald Schwank von der Universität Zürich, »Die meisten Krebsmedikamente sind immer noch Chemotherapeutika und sie werden auch bei Kindern eingesetzt – obwohl sie viele Mutationen verursachen. Man nimmt das in Kauf, weil die Krankheit lebensbedrohlich ist.«
Schwank arbeitet an der zweiten Generation der CRISPR-Proteine, den sogenannten Base- und Prime-Editoren. Mit Base-Editoren können einzelne DNA-Bausteine ausgetauscht werden. Das jüngste Werkzeug, die Prime-Editoren, sind vielseitiger, weil sich damit größere DNA-Abschnitte bearbeiten lassen. Der Eingriff ins Erbgut ist geringer als mit CRISPR/Cas9, da nur ein Strang des DNA-Fadens geschnitten wird, er ist sehr genau und funktioniert auch in ruhenden Zellen.
»Es gibt Schätzungen, wonach sich 60 Prozent der humanen pathogenen Mutationen mit Base-Editoren korrigieren lassen«, sagt Schwank. Noch gibt es allerdings nur präklinische Versuche in Tieren. Schwanks Team etwa hat mit Base-Editoren den krankhaft erhöhten Cholesterinspiegel in Mäusen und Makaken senken können, indem nur ein DNA-Baustein in einem Gen in der Leber ausgetauscht wurde. »Die Effizienz ist noch geringer als die der klassischen Genschere, aber das Potential ist da«, so Schwank.
Die größte Hürde für in vivo Gentherapien bleibt aber der Transport in die Zellen. Um einen Gendefekt zu reparieren, müssen die Werkzeuge über die Blutbahn gezielt in die entsprechenden Zelle gelangen und das millionenfach. Die ex-vivo-Therapien sind von der Problematik weniger betroffen: Durch einen kurzen Stromstoß nehmen die entnommenen Patientenzellen Das Protein und die zugehörige RNA auf und werden vor Anwendung am Patienten gründlich untersucht. »Da gibt es mittlerweile erprobte Protokolle«, sagt Cathomen, der an einer solchen Therapie für HIV-Patienten arbeitet. Für in vivo Gentherapien seien neben dem Auge, auch das innere Ohr gut geeignet. »Die Leber funktioniert auch sehr gut, weil alles, was in die Blutbahn gelangt, automatisch die Leber passiert, aber wenn man andere Organe erreichen möchte, wird die Luft sehr schnell dünn.«
Mit Volt und Viren
Um die Leber zu erreichen, nutzen Wissenschaftler ein ähnliches Prinzip wie bei der mRNA-Impfung gegen das Coronavirus. Lipidnanopartikel, die nur Leberzellen über bestimmte Rezeptoren aufnehmen können, transportieren die mRNA-Information für die Editierungs-Werkzeuge. Anders als bei der Impfung ist die Korrektur des Erbguts das erklärte Ziel. Da die mRNA in der Zelle nach wenigen Tagen abgebaut wird, reduziert sich das Risiko für Fehlschnitte. Bislang funktionieren die Nanopartikel aber nur in wenigen Zelltypen.
Viel mehr Erfahrung gibt es mit Viren als »Gentaxis«. Verwendet werden meist harmlose adeno-assozierte Viren. Viele Menschen sind mit verwandten Viren aber schon in Berührung gekommen, weswegen ein großer Teil dieser harmlosen Viren-Transporter effektiv vom Immunsystem beseitigt wird, bevor sie an ihr Ziel gelangen. »Viele Organe können wir einfach noch nicht ansteuern und haben da noch einen weiten Weg vor uns«, fasst es Cathomen zusammen.
Derweil werfen die Fortschritte auch ethische Fragen auf. Solche Therapien können bis zu zwei Millionen Dollar kosten. Wie sollen das solidarisch finanzierte Gesundheitssysteme stemmen, wie erst ärmere Länder, für die manche entwickelte Therapien besonders nützlich wären? Sichelzellanämie etwa ist in Afrika südlich der Sahara besonders verbreitet.
Und spätestens seit Ende 2018 die Nachricht um die Welt ging, dass ein Wissenschaftler in China Embryonen mit CRISPR/Cas9 verändert hat und dies zur Geburt von zwei Mädchen führte, ist auch der Öffentlichkeit klar, dass Eingriffe in die menschliche Keimbahn nicht länger ins Reich der Sciencefiction fallen.
In Embryonen ließen sich Gendefekte wohl leichter korrigieren, weil die Genschere nur in wenige Zellen eingeschleust werden muss. Da auch Samen- und Eizellen von der Korrektur betroffen wären, wäre sie aber vererbbar. In vielen Ländern, auch in der Schweiz und der EU, sind solche Eingriffe verboten. Neben grundsätzlichen ethischen Bedenken existieren auch handfeste medizinische, da die Verfahren unausgereift und die Langzeitfolgen nicht absehbar sind.
Und doch verschieben sich die Grenzen: Die internationale Kommission zum klinischen Einsatz von Genomeditierung in der Keimbahntherapie und auch der Deutsche Ethikrat, schließen einen Keimbahneingriff – Sicherheit und Wirksamkeit vorausgesetzt – bei schweren Gendefekten in Zukunft nicht mehr kategorisch aus.
Schreiben Sie uns!