Lexikon der Chemie: Aldolreaktion
Aldolreaktion, Aldolkondensation, Aldoladdition, ursprünglich die säure- oder basekatalysierte Dimerisierung aliphatischer Aldehyde mit α-ständigen Wasserstoffatomen unter Bildung von β-Hydroxyaldehyden (Aldole). So entsteht aus Acetaldehyd unter den Bedingungen der A. das Acetaldol:
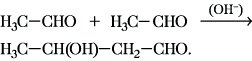
Im allg. Sinne werden alle Umsetzungen von Ketonen und Aldehyden mit CH-aciden Verbindungen als A. verstanden, da in allen Fällen der gleiche Reaktionsmechanismus durchlaufen wird. Der Mechanismus der A. unter basischen Bedingungen kann in folgender Weise formuliert werden:
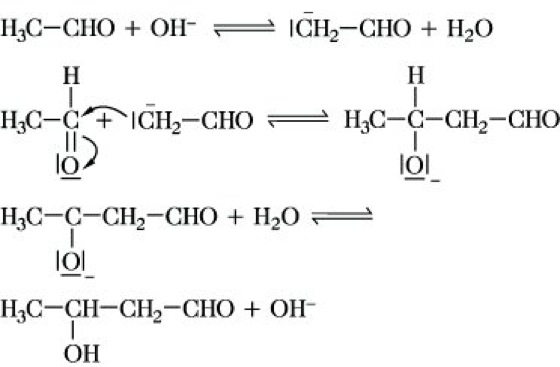
Der nucleophile Angriff des Carbanions am Carbonylkohlenstoffatom des Aldehyds ist als die eigentliche Aldoladdition zu betrachten. Das Additionsprodukt der basekatalysierten A. ist in vielen Fällen so stabil, daß es isoliert werden kann.
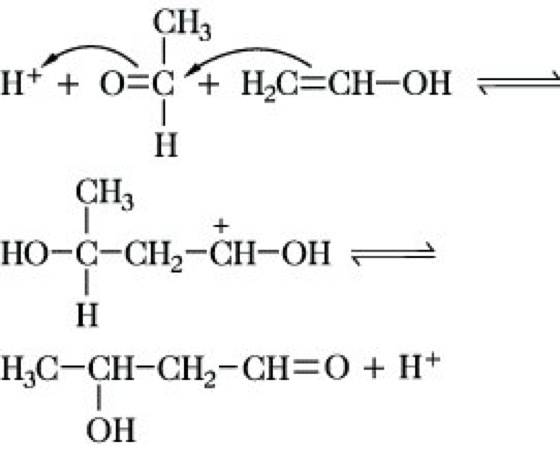
Die säurekatalysierte A. wird durch die Bildung der Enolform der CH-aciden Komponente eingeleitet:
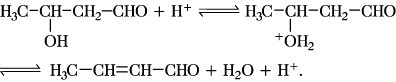
Das Reaktionsprodukt ist eine α,β-ungesättigte Carbonylverbindung, d. h. ein Produkt der Aldolkondensation im eigentlichen Sinne dieses Begriffes. Die Basekatalyse hat weitaus größere präparative Bedeutung als die Säurekatalyse.
Aldehyde, die kein α-ständiges Wasserstoffatom im Molekül enthalten, z. B. Benzaldehyd, sind der A. nicht zugänglich. Sie sind aber geeignet, als Carbonylkomponente mit anderen Aldehyden oder Ketonen die entsprechenden Aldolreaktionsprodukte zu bilden:
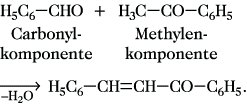
Beim Einsatz aromatischer Reaktionskomponenten erfolgt auch unter basischen Bedingungen in den meisten Fällen Wasserabspaltung aus den Additionsprodukten unter Bildung der α,β-ungesättigten Carbonylverbindungen. Die treibende Kraft für diesen Reaktionsschritt ist in der Ausbildung eines Systems konjugierter Doppelbindungen zu suchen.
Analog wie Aldehyde reagieren aliphatische Ketone zu β-Hydroxyketonen, z. B. entsteht bei der A. von Aceton Diacetonalkohol:
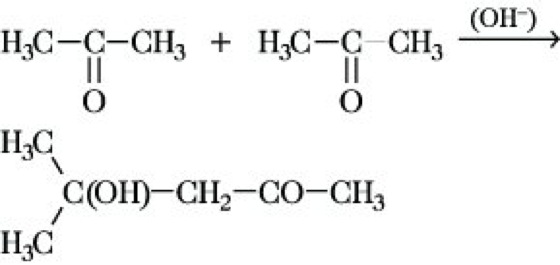
Bei der säurekatalysierten Reaktion wird dieser zum Mesityloxid dehydratisiert.
Unterwirft man ein Gemisch eines Aldehyds und eines Ketons, die jeweils α-ständige Wasserstoffatome enthalten und somit beide zur A. befähigt sind, dieser Reaktion, reagiert stets der Aldehyd aufgrund der höheren Carbonylreaktivität als Carbonylkomponente und das Keton als Methylenkomponente. Das Reaktionsprodukt ist in diesen Fällen immer ein β-Hydroxyketon. Anstelle von Aldehyden oder Ketonen können als Methylenkomponenten bei der A. auch andere CH-acide Verbindungen, wie Malonsäureester, Cyanessigsäureester, Malonsäuredinitril, Acetessigester und aliphatische Nitroverbindungen, verwendet werden. Somit können Reaktionen wie z. B. die Knoevenagel-Kondensation, die Perkin-Reaktion oder die Darzens-Erlenmeyer-Claisen-Kondensation als spezielle Verfahren der A. betrachtet werden. Die Reaktivität der Carbonylkomponenten nimmt in der Reihe Ketone, verzweigte Aldehyde, geradkettige Aldehyde zu. Die A. ist in allen Reaktionsschritten reversibel. Durch Säuren oder Basen können die Additionsprodukte in die Ausgangskomponenten gespalten werden.
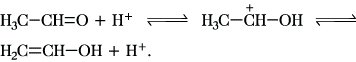
Schreiben Sie uns!