Lexikon der Chemie: Monocarbonsäuren
Monocarbonsäuren, organische Verbindungen mit einer Carboxygruppe -COOH im Molekül. In Abhängigkeit vom organischen Rest, an den die Carboxygruppe gebunden ist, unterscheidet man aliphatische, aromatische und heterocyclische M. Aliphatische M. werden aufgrund des Vorkommens einiger höherer Homologe in den Fetten auch als Fettsäuren bezeichnet.
Gesättigte aliphatische M. Die homologe Reihe kann durch die allg. Formel CnH2n+1COOH oder CnH2nO2 beschrieben werden. Aufgrund ihres Vorkommens in freier oder gebundener Form im Tier- und Pflanzenreich haben zahlreiche M. Trivialnamen. Die systematische Bezeichnung erfolgt in gleicher Weise wie bei anderen Carbonsäuren (Tab.).
Monocarbonsäuren. Tab.: Gesättigte, aliphatische Monocarbonsäuren.
| ||||
| Ameisensäure | Methansäure | H-COOH | 8,4 | |
| Essigsäure | Ethansäure | CH3-COOH | 16,6 | |
| Propionsäure | Propansäure | CH3-CH2-COOH | -20,8 | |
| Buttersäure | Butansäure | CH3-(CH2)2-COOH | -6,5 | |
| Isobuttersäure | 2-Methylpropansäure | (CH3)2-CH-COOH | -47,0 | |
| Valeriansäure | Pentansäure | CH3-(CH2)3-COOH | -34,5 | |
| Capronsäure* | Hexansäure | CH3-(CH2)4-COOH | -9,5 | |
| Önanthsäure*) | Heptansäure | CH3-(CH2)5-COOH | -10,0 | |
| Caprylsäure*) | Octansäure | CH3-(CH2)6-COOH | 16,5 | |
| Pelargonsäure*) | Nonansäure | CH3-(CH2)7-COOH | 12,0 | |
| Caprinsäure*) | Decansäure | CH3-(CH2)8-COOH | 31,5 | |
| Undecylsäure*) | Undecansäure | CH3-(CH2)9-COOH | 28,6 | |
| Laurinsäure | Dodecansäure | CH3-(CH2)10-COOH | 44,0 | |
| – | Tridecansäure | CH3-(CH2)11-COOH | 40,5 | |
| Myristinsäure | Tetradecansäure | CH3-(CH2)12-COOH | 58,0 | |
| – | Pentadecansäure | CH3-(CH2)13-COOH | 52,1 | |
| Palmitinsäure | Hexadecansäure | CH3-(CH2)14-COOH | 64,0 | |
| Margarinsäure | Heptadecansäure | CH3-(CH2)15-COOH | 62,0 | |
| Stearinsäure | Octadecansäure | CH3-(CH2)16-COOH | 69,4 | |
| – | Nonadecansäure | CH3-(CH2)17-COOH | 69,4 | |
| Eicosansäure | Arachinsäure*) | CH3-(CH2)18-COOH | 75,3 |
Die niederen Homologen, von C1 bis C3, sind farblose Flüssigkeiten mit stechendem, die C4- bis C9-M. mit ranzigem Geruch. Die höheren Homologen sind feste, geruchlose Verbindungen. Ähnlich wie die gesättigten aliphatischen Kohlenwasserstoffe zeigen die M. eine analoge Alternanz der Schmelzpunkte, die durch die Oszillationsregel beschrieben wird. Danach schmelzen M. mit ungerader C-Atomanzahl bei tieferen, die geradzahligen benachbarten M. bei höheren Temperaturen.
Ungesättigte aliphatische M. Sie enthalten eine oder mehrere C=C-Doppel- oder/und C≡C-Dreifachbindungen. Entsprechend ihrer Position unterscheidet man M. mit isolierten bzw. konjugierten Mehrfachbindungen. Die Acrylsäure ist die einfachste ungesättigte M., in der die C=C-Doppelbindung und die C=O-Gruppe in Konjugation stehen. Vinylessigsäure ist eine M. mit isolierter C=C-Doppelbindung. Durch Einwirkung von Laugen oder Mineralsäuren wird diese leicht in die isomere Crotonsäure mit konjugiertem Mehrfachbindungssystem umgewandelt:
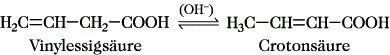
Diese Art der Isomerisierung wird als Dreikohlenstofftautomerie bezeichnet. Die wichtigste ungesättigte Fettsäure ist die Ölsäure. Weitere bekannte M. mit C-C-Mehrfachbindungen sind die Zimtsäure sowie die Propiolsäure, die einfachste M. mit einer C≡C-Dreifachbindung. Die Schmelzpunkte der M. werden durch Verzweigung bzw. Einführung von Doppelbindungen deutlich erniedrigt. Ungesättigte M. mit Z-Konfiguration weisen in den meisten Fällen niedrigere Schmelzpunkte auf als solche mit E-Konfiguration. Mehrfach ungesättigte M. mit isolierten C=C-Doppelbindungen schmelzen bei tieferen Temperaturen als M. mit konjugiertem π-Bindungssystem.
Aromatische M. Hier ist die Carboxygruppe direkt an ein C-Atom des aromatischen Systems gebunden. Die einfachste aromatische M. ist die Benzoesäure. Weitere bekannte Verbindungen dieses Typs sind die α-Naphthoesäure sowie die β-Naphthoesäure. Wichtiger als die einfachen aromatischen M. sind die vielfältigen Substitutionsprodukte, z. B. Anthranilsäure, 4-Aminobenzoesäure und Salicylsäure.
Heterocyclische M. Sie enthalten wie die aromatischen Verbindungen eine COOH-Gruppe an einem C-Atom des Ringsystems. Bekannte heterocyclische M. sind z. B. Brenzschleimsäure oder Furan-2-carbonsäure sowie die Nicotinsäure oder Pyridin-3-carbonsäure.
Eigenschaften. M. reagieren, wie alle anderen Carbonsäuren, aufgrund der relativ leichten Abspaltbarkeit des Protons der Carboxygruppe sauer. Im Vergleich zu den starken Mineralsäuren liegt dieses Dissoziationsgleichgewicht überwiegend auf der Seite der undissoziierten Form, d. h., M. sind schwache Säuren. Die Einführung elektronegativer Substituenten insbesondere am α-Kohlenstoffatom bewirkt eine starke Erhöhung des Säurecharakters, z. B. liegt der pKS-Wert der Essigsäure bei 4,76, der pKS-Wert der Trichloressigsäure bei 0,6. M. haben im Vergleich zu entsprechenden Alkoholen und Phenolen niedrige Siedepunkte. Die Ursache dafür liegt in der Eigenschaft der M., dimere Assoziate zu bilden, die bei einer Reihe von Verbindungen auch in der Gasphase nachweisbar sind:
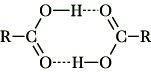
Durch Ersatz eines oder mehrerer Wasserstoffatome im organischen Rest sowie durch Überführung der Carboxygruppe in Ester, Säureamide, Säurehalogenide, Salze u. a. sind eine Vielzahl substituierter M. und Monocarbonsäurederivate zugänglich.
Darstellung. Die aliphatischen M. werden hauptsächlich durch oxidative Abwandlung von Alkanen, primären Alkoholen oder Aldehyden dargestellt. Höhere M. können auch durch hydrolytische Spaltung von Lipiden gewonnen werden. Die aromatischen M. werden vorwiegend durch hydrolytische Spaltung entsprechender Nitrile und Trihalogenmethylverbindungen hergestellt. Darüber hinaus ist eine Vielzahl weiterer allgemeiner und spezieller Methoden bekannt.
Schreiben Sie uns!